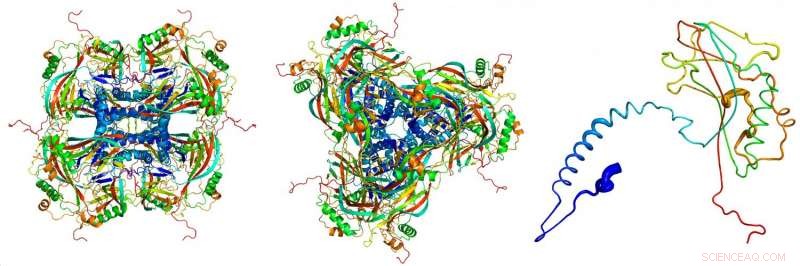
Modelo atômico dos corpos de oclusão cristalinos, derivado das imagens de difração de raios-X registradas no LCLS de laser de elétrons livres de raios-X no SLAC National Accelerator Laboratory. As proteínas individuais (direita) se unem para formar os blocos de construção (esquerda, visto de lado; Centro, visto de cima) dos corpos de oclusão cristalinos. Crédito:Dominik Oberthuer, CFEL / DESY
Uma equipe internacional de cientistas usou pulsos de raios-X de alta intensidade para determinar a estrutura do envelope proteico cristalino de um vírus de inseto. Sua análise revela os pequenos detalhes dos blocos de construção que compõem o casulo viral em uma escala de 0,2 nanômetros (milionésimos de um milímetro) - aproximando-se da resolução em escala atômica. Os minúsculos vírus com seu invólucro de cristal são de longe os menores cristais de proteína já analisados por cristalografia de raios-X. Isso abre novas oportunidades no estudo de estruturas de proteínas, como a equipe liderada pelo cientista líder do DESY, Henry Chapman, do Center for Free-Electron Laser Science, relata no Proceedings of the National Academy of Sciences ( PNAS )
"O granulovírus ataca certos insetos e os mata. Isso inicialmente o deixa preso dentro do hospedeiro em decomposição, então ele tem que se proteger, talvez por anos, contra condições ambientais adversas, como calor, radiação ultravioleta e seca, até que seja novamente ingerido por um inseto. Para alcançar isto, o vírus se envolve em um casulo feito de cristais de proteína, que só se dissolve novamente quando atinge o intestino de um inseto, "explica Cornelius Gati do DESY, o autor principal do artigo. Esses vírus são de interesse particular de Peter Metcalf da Universidade de Auckland na Nova Zelândia e de Johannes Jehle do Instituto Julius Kühn em Darmstadt, que se juntou ao DESY para esta pesquisa. Os pesquisadores examinaram o casulo do Cydia pomonella granulovírus (CpGV), que infecta as lagartas da mariposa codling ( Cydia pomonella ) e é usado na agricultura como um pesticida biológico. O vírus é inofensivo para os humanos.
Os cientistas estão interessados na estrutura espacial das proteínas e outras biomoléculas porque isso esclarece a maneira precisa como funcionam. Isso levou a uma ciência especializada conhecida como biologia estrutural. "Nos últimos 50 anos, cientistas determinaram as estruturas de mais de 100, 000 proteínas, "diz Chapman, que também é professor de física na Universidade de Hamburgo. "De longe, a ferramenta mais importante para isso é a cristalografia de raios-X." Neste método, um cristal da proteína sob investigação é cultivado e irradiado com raios-X brilhantes. Isso produz um padrão de difração característico, a partir da qual a estrutura espacial do cristal e seus blocos de construção podem ser calculados.
“Um dos grandes desafios desse procedimento é, Contudo, crescendo os cristais, "acrescenta Chapman. Muitas proteínas não se alinham prontamente para formar cristais, porque esse não é seu estado natural. Quanto menores forem os cristais que podem ser usados para a análise, mais fácil é cultivá-los, mas o mais difícil é medi-los. "Esperamos que no futuro possamos dispensar completamente o crescimento de cristais e estudar moléculas individuais diretamente usando raios-X, "diz Chapman, "então gostaríamos de entender os limites".
"Essas partículas de vírus nos forneceram os menores cristais de proteína já usados para análise de estrutura de raios-X, "explica Gati. O corpo de oclusão (o" casulo "do vírus) tem um volume de cerca de 0,01 micrômetros cúbicos, cerca de cem vezes menor do que os menores cristais de proteína cultivados artificialmente que até agora foram analisados usando técnicas cristalográficas.
Para quebrar esse limite no tamanho do cristal, um feixe de raios-X extremamente brilhante era necessário, que foi obtido usando um chamado laser de elétrons livres (FEL), em que um feixe de elétrons de alta velocidade é guiado através de um ondulador magnético, fazendo com que eles emitam pulsos de raios-X semelhantes a laser.
Os cientistas usaram o laser de elétrons livres LCLS no SLAC National Accelerator Laboratory nos EUA, e empregou óptica para focar cada pulso de raio-X em um tamanho semelhante ao de uma das partículas de vírus. "Direcionar todo o poder do FEL para um minúsculo vírus o expôs a tremendos níveis de radiação, "relata Gati, que agora trabalha no SLAC. A dose foi de 1,3 bilhão de cinzas; para comparação:a dose letal para humanos é de cerca de 50 Grays.
A dose de FEL certamente foi letal para os vírus também - cada um foi completamente vaporizado por um único pulso de raio-X. Mas o pulso de duração de femtossegundo transporta as informações da estrutura original para o detector e a destruição do vírus ocorre apenas após a passagem do pulso. A análise da difração registrada mostrou que mesmo minúsculos cristais de proteína que são bombardeados com doses de radiação extremamente altas ainda podem revelar sua estrutura em escala atômica.
"Simulações baseadas em nossas medições sugerem que nosso método pode provavelmente ser usado para determinar a estrutura de cristais ainda menores consistindo de apenas centenas ou milhares de moléculas, "relata Chapman, que também é membro do Hamburg Center for Ultrafast Imaging (CUI). "Isso nos dá um grande passo em direção ao nosso objetivo de analisar moléculas individuais."