Encontrando a fenda na armadura do coronavírus – experimento revela como a principal protease do SARS-CoV-2 se protege
 A compreensão da estrutura e do ciclo de vida do vírus SARS-CoV-2 é essencial para o desenvolvimento de vacinas e terapias. Crédito:CFEL
A compreensão da estrutura e do ciclo de vida do vírus SARS-CoV-2 é essencial para o desenvolvimento de vacinas e terapias. Crédito:CFEL A pandemia de COVID-19 resultou em milhões de mortes. Apesar de um esforço de investigação colaborativa sem paralelo que levou à produção de vacinas e terapias eficazes num tempo recorde, ainda falta uma compreensão completa da estrutura e do ciclo de vida do coronavírus conhecido como SARS-CoV-2.
Os cientistas usaram os biolaboratórios e o instrumento SPB/SFX no XFEL europeu para estudar a principal protease, ou Mpro, do vírus para compreender como este se protege dos danos oxidativos. Os resultados acrescentam conhecimentos essenciais à nossa compreensão do funcionamento do SARS-CoV-2 e do campo da biologia viral.
O artigo foi publicado na revista Nature Communications .
Entre Janeiro de 2020 e Março de 2023, mais de seis milhões de pessoas morreram em consequência da doença respiratória COVID-19 e várias centenas de milhões foram infectadas. A doença é causada pelo SARS-CoV-2, um coronavírus.
“Os coronavírus são um grupo de vírus RNA que causam doenças e enfermidades em mamíferos e aves”, explica o cientista europeu XFEL Richard Bean. “No entanto, apesar da sua relevância significativa para a saúde humana global, ainda há muito a aprender sobre a estrutura e função dos coronavírus em geral e do SARS-CoV-2 em particular”.
Em resposta ao surto da pandemia, cientistas e organizações científicas em todo o mundo concentraram esforços no estudo da estrutura, dinâmica e função do SARS-CoV-2 em busca de vacinas e terapias. Devido ao seu papel central no ciclo de replicação do vírus, a principal protease – uma enzima que liberta pedaços recém-fabricados do vírus uns dos outros – rapidamente emergiu como um alvo-chave dos medicamentos antivirais.
A protease principal, ou Mpro, é particularmente atraente para o desenvolvimento de medicamentos porque desempenha um papel central na replicação viral e também porque é bastante diferente de todas as proteínas humanas. Isto permite que as terapias atinjam especificamente o vírus, ao mesmo tempo que minimizam os efeitos secundários que podem prejudicar os pacientes. Programas anteriores de descoberta de medicamentos direcionados a outros vírus tiveram sucesso usando inibidores de protease viral, tornando mais provável um resultado bem-sucedido no caso do SARS-CoV-2.
“Embora o auge da pandemia de COVID-19 possa ter passado, ainda há muito valor no estudo do vírus SARS-CoV-2”, diz Thomas Lane, do Centro de Ciência do Laser de Elétrons Livres (CFEL) em Hamburgo. "A COVID continua a representar uma ameaça significativa à saúde em todo o mundo. Dada a persistência deste vírus e o possível surgimento de futuros coronavírus patogénicos, é imperativo que desenvolvamos uma compreensão mais profunda do Mpro e do seu papel na função viral."
Em um experimento recente no instrumento SPB/SFX no XFEL europeu, Lane e colegas usaram o intenso feixe de raios X para estudar o Mpro. Vários estudos estruturais anteriores centrados no Mpro destacaram uma série de peculiaridades.
“Em primeiro lugar, a proteína forma uma estrutura 3D conhecida como dímero quando é encontrada em altas concentrações”, explica o cientista europeu XFEL Robin Schubert, que esteve envolvido na experiência. “Este hábito estrutural parece influenciar diretamente a sua atividade – mas não sabemos exatamente por que isso é importante para o vírus”. Juntamente com os principais insights sobre a estrutura 3D, estudos recentes também sugeriram a importância dos níveis de oxigênio celular para a atividade da protease.
“Parece que mesmo uma exposição moderada ao oxigênio diminui a atividade do Mpro”, explica Patrick Reinke, também do CFEL. Na verdade, na presença de oxigênio suficiente, a renovação cessa completamente. Mas este processo é reversível – se o oxigénio for removido, a enzima reativa-se, sugerindo que o sistema desenvolveu mecanismos de proteção para sobreviver num ambiente oxidativo.
“Demonstrou-se que o stress oxidativo regula a função de outros vírus, como o VIH”, acrescenta Reinke. "Foi sugerido que mudanças estruturais na protease permitem que ela escape do dano oxidativo em ambientes ricos em oxigênio. No entanto, ainda não temos certeza de como esses mecanismos de proteção afetam a aptidão viral".
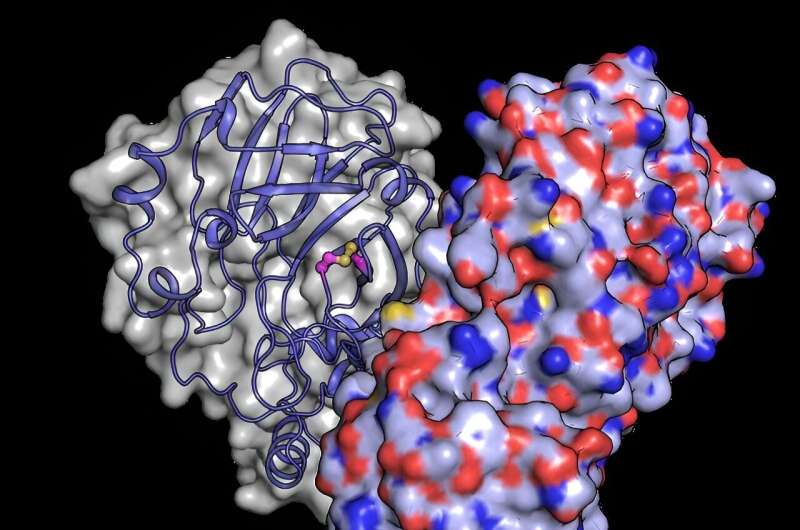
Para entender melhor como as mudanças estruturais protegem a proteína dos danos do oxigênio, a equipe usou o poderoso feixe de raios X do XFEL europeu para revelar a estrutura do Mpro depois de ter sido exposto ao oxigênio. Eles descobriram um rearranjo estrutural do Mpro no qual se forma uma ligação entre dois resíduos de cisteína:o sítio ativo cisteína C145 e uma cisteína distal C117.
Para conseguir isso, a equipe produziu grandes quantidades de Mpro ao longo de vários meses nos biolaboratórios do European XFEL e o transformou em microcristais, alguns dos quais foram cultivados na presença de oxigênio. Finalmente, os microcristais foram lançados voando na frente do feixe europeu XFEL no instrumento SPB/SFX usando um jato líquido.
Esses pequenos cristais são impossíveis de estudar usando fontes de luz tradicionais porque a quantidade de radiação necessária para gerar dados suficientes dos cristais os destruiria. Os pulsos de raios X produzidos pelo XFEL europeu, no entanto, são tão poderosos e curtos que podem ser usados para capturar uma imagem do cristal da proteína antes que ele tenha tempo de se desintegrar.
“Nossos resultados mostram que o sítio ativo cisteína, que conduz a química da enzima, pode se esconder sorrateiramente do dano oxidativo”, diz Schubert. Normalmente, a oxidação pode danificar irreversivelmente as cisteínas.
Após a oxidação, entretanto, o Mpro protege sua cisteína mais importante, formando o que é conhecido como “ligação dissulfeto”, que a enterra no núcleo da estrutura da proteína. Então, se for movido de volta para um ambiente seguro e com baixo teor de oxigênio, a ligação dissulfeto pode quebrar, revelando a cisteína ativa, que retoma sua função original.
“Os experimentos realizados no XFEL europeu revelam uma imagem da proteína em seu estado dissulfeto oculto, confirmando sua existência e descobrindo como funciona”, diz Schubert.
"Mpro exibe um conjunto extraordinariamente rico de modificações de oxidação, e nosso experimento acrescenta uma peça-chave a essa história", diz Lane. Os cientistas estão entusiasmados com o que seus dados indicam e com os próximos passos. "Mpro é um elemento fundamental da biologia do coronavírus e o principal alvo da terapêutica anti-COVID-19 de pequenas moléculas.
"Demonstrou-se que a função da enzima é regulada tanto por dimerização quanto por oxidação, e está claro que esses mecanismos regulatórios estão biofisicamente correlacionados. Embora nossas estruturas forneçam informações mecanísticas sobre essas propriedades do Mpro, devemos agora entender como a regulação baseada no estresse oxidativo ou a concentração de proteínas impacta a aptidão viral. Isso fornecerá uma visão mais profunda da biologia viral e, esperançosamente, abrirá novas oportunidades para perturbar essa biologia com medicamentos que preservam a vida”.
