Químicos desenvolvem novo método para introdução de componentes fluorados em moléculas
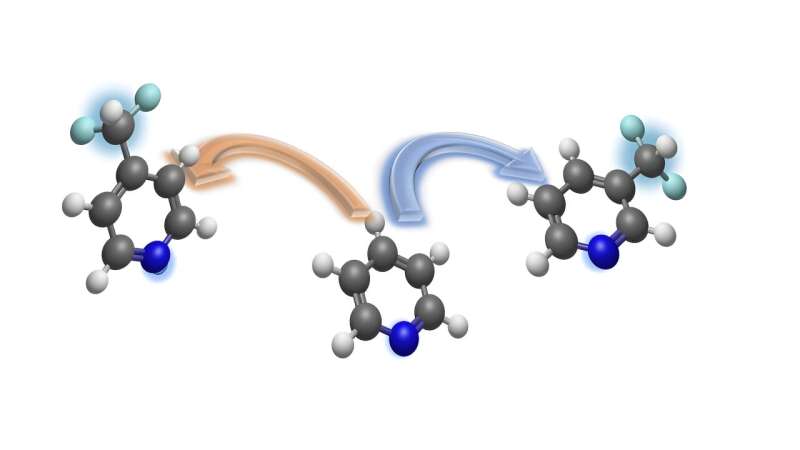 Com seu método recém-desenvolvido, os químicos podem incorporar com precisão um grupo difluorometil (destacado em azul claro) regiosseletivamente, ou seja, em certas posições, em anéis de piridina - seja na posição para (seta amarela) ou na posição meta (seta azul). seta). O átomo de nitrogênio dentro do anel de piridina é mostrado em azul escuro. Crédito:Grupo Studer
Com seu método recém-desenvolvido, os químicos podem incorporar com precisão um grupo difluorometil (destacado em azul claro) regiosseletivamente, ou seja, em certas posições, em anéis de piridina - seja na posição para (seta amarela) ou na posição meta (seta azul). seta). O átomo de nitrogênio dentro do anel de piridina é mostrado em azul escuro. Crédito:Grupo Studer Uma equipe de químicos da Universidade de Münster desenvolveu um método de síntese para a integração seletiva do local do grupo difluorometil biologicamente relevante em piridinas.
O grupo difluorometil frequentemente determina as propriedades das moléculas bioativas e é, portanto, particularmente interessante para a pesquisa de medicamentos. Este grupo atômico consiste em carbono, dois átomos de flúor e um átomo de hidrogênio. Os derivados do composto químico piridina são particularmente adequados para inclusão em grupos difluorometil.
Se um átomo de hidrogênio nas piridinas for substituído por tal grupo, estruturas em anel difluorometilado podem ser obtidas de forma descomplicada, que são potenciais candidatas a novos medicamentos e agroquímicos. Em termos de eficácia, a posição do grupo difluorometil dentro da molécula desempenha um papel vital.
Uma equipe de pesquisadores liderada pelo Prof Dr. Armido Studer do Instituto de Química Orgânica da Universidade de Münster (Alemanha) apresentou agora uma nova estratégia com a qual o grupo difluorometil pode ser introduzido com precisão em piridinas em locais específicos. Os resultados foram publicados na revista Nature Communications.
A piridina é um importante alicerce na indústria farmacêutica e agroquímica para a produção de substâncias biologicamente ativas. A piridina e seus derivados contêm anéis com cinco átomos de carbono e um átomo de nitrogênio. Usando o novo método, o grupo difluorometil pode ser introduzido na posição meta (dois átomos de distância do nitrogênio) ou na posição para (três átomos de distância do nitrogênio).
O método é promissor porque a difluorometilação regiosseletiva de piridinas é considerada um desafio na área química. Não havia métodos anteriormente conhecidos para meta e para-difluorometilação seletiva de local que pudessem ser alternados entre as duas posições. “Nosso estudo resolve o problema da difluorometilação direta do anel piridina na posição meta, que é particularmente difícil de acessar em compostos complexos”, explica Studer.
Como as piridinas são compostos bastante inertes, os químicos aplicaram uma estratégia de desaromatização temporária. Os intermediários ativos desaromatizados reagem com reagentes contendo grupos difluorometil para formar as piridinas quimicamente funcionalizadas. Este método também é adequado para a difluorometilação de medicamentos contendo piridina no final da sequência de síntese. Os derivados de piridina podem, portanto, ser facilmente convertidos em vez de terem de ser meticulosamente reconstituídos.
"Nosso método é prático e pode ser realizado com reagentes baratos e disponíveis comercialmente. Isso deve tornar nosso método relevante para o projeto de medicamentos", diz o pesquisador de pós-doutorado Dr. Pengwei Xu. "Esperamos que nossa abordagem encontre aplicação nas indústrias farmacêutica e agroquímica."
