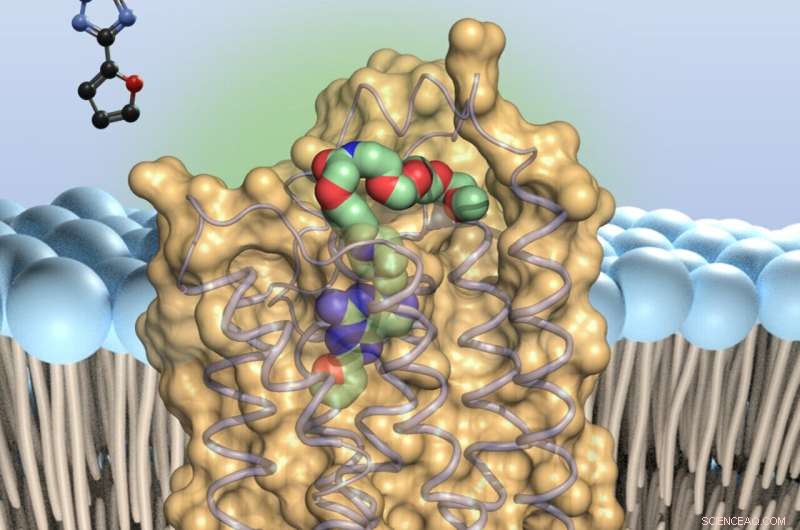
O antagonista de adenosina (colorido) - liga-se a pequenas antenas na superfície das células imunes, os receptores de adenosina do tipo 2A. Isso retarda as tropas imunes. Crédito:Universidade de Bonn
O receptor A2A regula o quão vigorosamente o sistema imunológico inato ataca as células doentes. Pesquisadores da Universidade de Bonn conseguiram agora mostrar pela primeira vez como um importante inibidor se liga ao receptor. No futuro, os resultados facilitarão a busca direcionada por moléculas que dão mais força ao sistema imunológico inato. Estes poderiam, por exemplo, ser utilizados na luta contra o cancro, mas também contra doenças cerebrais como a doença de Alzheimer ou a doença de Parkinson. A versão final do estudo foi publicada na revista
Angewandte Chemie International Edition .
Quem gosta de ler thrillers sabe:antes de ladrões invadirem uma mansão, eles gostam de jogar uma costeleta suculenta por cima da cerca, na qual esconderam alguns comprimidos para dormir. Quando os cães de guarda chegam ao segundo jantar, eles sucumbem ao sono profundo logo depois. As jóias da dona da casa mudam de mãos muito mais imperturbáveis depois disso.
As células tumorais geralmente procedem de maneira muito semelhante:elas expulsam pílulas para dormir que paralisam o sistema imunológico. Mais especificamente, eles se cercam de uma nuvem de adenosina, um importante mensageiro endógeno. Dessa forma, eles desativam as próprias "células assassinas" do corpo, que de outra forma fariam com que as células cancerígenas morressem.
Isso ocorre porque as moléculas de adenosina se ligam a pequenas antenas na superfície das células imunes, os receptores A2A (a abreviação significa "receptores de adenosina tipo 2A"). Isso derruba as tropas defensivas, por assim dizer. Pesquisadores de todo o mundo estão, portanto, procurando moléculas que possam bloquear o receptor A2A e impedir o efeito paralisante da adenosina.
Bombardeio com raios-X "Nosso estudo deve tornar essa pesquisa muito mais fácil", explica a Profa. Dra. Christa Müller, do Instituto Farmacêutico da Universidade de Bonn. "Adicionamos novas variantes de um inibidor conhecido, uma substância chamada preladenant, ao receptor A2A. Então criamos cristais a partir dos complexos receptor-inibidor - é a primeira vez no mundo que isso foi alcançado com substâncias semelhantes a preladenant. "
A cristalização permitiu elucidar a estrutura do complexo. "Para isso, bombardeamos o composto com raios X", explica Tobias Claff, que realizou a maior parte dos experimentos. "O cristal difrata os raios. A maneira como ele faz isso nos permite deduzir a estrutura espacial do complexo - até o arranjo de átomos individuais e suas interações."
Dessa forma, os pesquisadores conseguiram mostrar em quais pontos o pré-ladenante do receptor A2A se liga. Com este conhecimento, agora é possível modificar especificamente o inibidor para dar-lhe melhores propriedades. Além de ter o efeito mais forte possível, os medicamentos, por exemplo, não devem ser decompostos muito rapidamente. Eles também precisam ser capazes de chegar ao local onde devem fazer seu trabalho – neste caso, o cérebro. "Nosso estudo tornará muito mais fácil otimizar a substância", diz Claff com otimismo.
A2A pertence a um grupo de receptores que regulam as principais funções do corpo. Eles atravessam a membrana das células. A parte deles que fica do lado de fora da membrana serve como sensor, recebendo sinais moleculares como uma antena. Quando isso acontece, desencadeia reações específicas com sua parte que se projeta para dentro da célula. Isso então ativa certos genes, por exemplo.
Corante ligado à molécula inibidora "Esses receptores são imensamente importantes por causa de sua posição central", diz Christa Müller, que também é membro das Áreas de Pesquisa Transdisciplinar (TRA) "Building Blocks of Matter" e "Life and Health". "Muitos deles, no entanto, infelizmente são relativamente instáveis. Isso é desfavorável para análises estruturais de raios-X - a cristalização leva dias, às vezes até semanas." Os pesquisadores, portanto, modificaram especificamente o receptor A2A em um único ponto, tornando-o consideravelmente mais estável.
Além disso, eles conseguiram anexar um corante ao pré-ladenante com uma espécie de cordão molecular. "Isso nos permite controlar onde no tecido o preladenant se liga ao receptor A2A", diz Müller. Ao mesmo tempo, o comprimento e a flexibilidade do nanostring garantem que o inibidor não seja impedido de se ligar ao receptor.
Ambos os avanços também podem servir de modelo para o trabalho com outros receptores que pertencem ao mesmo grupo. "Os métodos que desenvolvemos em Bonn nos últimos anos nos permitirão elucidar a estrutura dessas e de outras proteínas da membrana celular no futuro", está convencido do farmacêutico. "Não há muitas instalações de pesquisa que possam fazer esse tipo de análise estrutural de moléculas extremamente complexas."
+ Explorar mais Descoberta ativação do receptor opióide
