Os segmentos do receptor CysLT1 responsáveis por sua ativação são mostrados em laranja, próximo a outros receptores acoplados à proteína G. Crédito:Luginina et al./Science Advances
Uma equipe de pesquisa do Centro MIPT para Mecanismos Moleculares do Envelhecimento e Doenças Relacionadas à Idade colaborou com colegas dos EUA, Canadá, França, e Alemanha para determinar a estrutura espacial do receptor CysLT1. O artigo foi publicado em Avanços da Ciência .
Receptores acoplados à proteína G, ou GPCRs, são máquinas moleculares incorporadas às membranas celulares. Esses receptores captam sinais específicos do lado de fora de uma célula e os transmitem para dentro da célula. Os sinais vêm de várias fontes, incluindo fótons de luz, moléculas de gordura, pequenas proteínas, e fragmentos de DNA. Um GPCR pode desencadear diversos eventos na célula, como divisão, realocação, ou mesmo a morte.
A "comunicação" celular mediada por GPCR é crucial para o funcionamento de um organismo. Não é de admirar que esses receptores estejam de alguma forma envolvidos em todos os processos do nosso corpo. Eles são o alvo de cerca de 40% dos medicamentos existentes, também. Assim, é interessante para os biólogos estruturais compreender o mecanismo de funcionamento dessas máquinas biológicas e encontrar uma maneira de afetá-las, desenvolvendo novos medicamentos que possuem mais especificidade e menos efeitos colaterais.
A biologia estrutural é um campo interdisciplinar na interface da física e da biologia, preocupada em estudar o arranjo 3-D de macromoléculas biológicas, como proteínas. Os estudos estruturais envolvem engenharia genética, produção de proteína artificial, purificação, e cristalização. Uma vez que o cristal de proteína foi obtido, a física chega:os pesquisadores expõem o cristal da proteína a poderosos raios-X para gerar padrões de difração. Os dados resultantes podem ser processados matematicamente para recuperar uma estrutura atômica 3D detalhada de uma determinada molécula de proteína, com uma precisão de até vários angstroms.
Os estudos estruturais dependem de fontes poderosas de raios-X. Eles normalmente vêm em dois tipos:síncrotrons e os lasers de elétrons livres desenvolvidos mais recentemente. Em ambos os casos, os elétrons são acelerados quase à velocidade da luz. Eles são então forçados a mudar sua velocidade ou direção de movimento, levando à emissão de raios-X. Em um síncrotron, os elétrons se movem ao longo de uma curva, trajetória quase circular. Em um laser de elétrons livres, eles viajam através de uma passagem entre duas filas de ímãs alternados de direção oposta, conhecido como ondulador.
Embora os biólogos estruturais usem síncrotrons desde 1970, lasers de elétrons livres são uma adição relativamente recente ao kit de ferramentas de cristalografia de proteínas. Introduzido no início de 2010, eles geram radiação extremamente poderosa e permitem a análise de difração de raios-X de cristais minúsculos de 1 micrômetro. Este novo instrumento já trouxe a descoberta de várias centenas de estruturas.
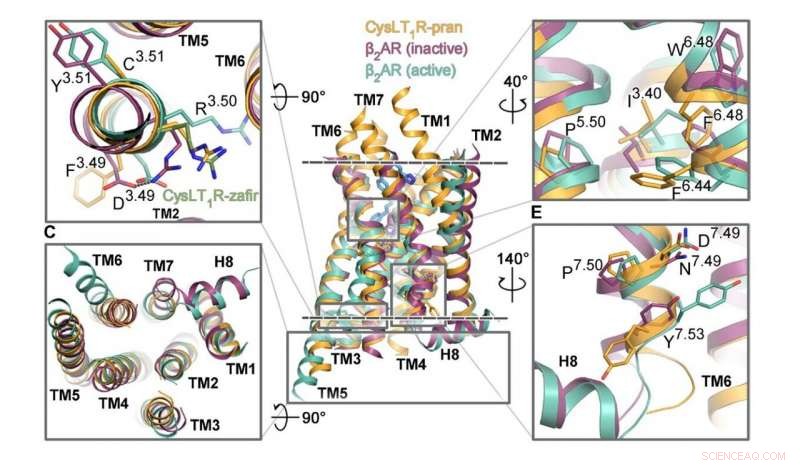
Pesquisadores do MIPT investigaram a estrutura de um GPCR conhecido como CysLT1. Está envolvida em processos inflamatórios e desempenha um papel importante nas doenças alérgicas, incluindo asma, que afeta cerca de 10% da população global. A equipe de biofísicos obteve a estrutura 3-D detalhada do receptor com as moléculas de zafirlukast e pranlukast. Estes são dois medicamentos prescritos para pacientes com asma, rinite alérgica, e urticária.
Embora seja relativamente grande, Cristais de 0,3 milímetros com pranlucaste foram cultivados no estudo, os cristais com zafirlucaste atingiram apenas o tamanho de vários micrômetros. As primeiras amostras foram investigadas no síncrotron ESRF em Grenoble, França. Os últimos foram examinados usando a fonte de luz Linac Coherent operada pela Universidade de Stanford, um laser de elétron livre. Os colegas dos pesquisadores do Canadá ajudaram a explorar os mecanismos de transmissão do sinal via CysLT1.
"Estas são, sem dúvida, estruturas únicas, e gostamos muito deles, "disse o co-autor do estudo Aleksandra Luginina do Laboratório MIPT de Biologia Estrutural de Receptores Acoplados à Proteína G." O mecanismo de operação do receptor CysLT1 atualiza como vemos o funcionamento dos subgrupos da proteína GPCR. Também, identificando os locais de ligação para as moléculas de zafirlucaste e pranlucaste, lançamos a base para melhorar os medicamentos para asma - aumentando sua eficiência e reduzindo os efeitos colaterais. "
GPCRs são objetos notoriamente difíceis para estudos estruturais. Apenas um punhado de laboratórios em todo o mundo conseguiram concluir projetos de pesquisa desse tipo. A equipe do MIPT está feliz que um laboratório do Instituto agora esteja entre eles.