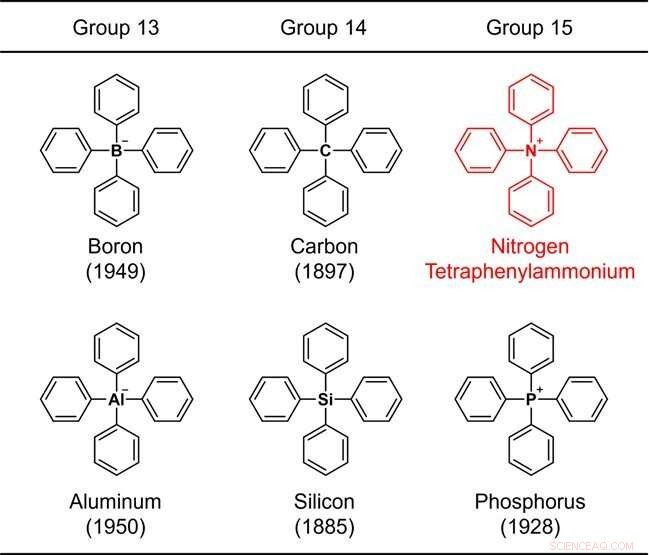
Figura 1. Estruturas de elementos tetrafenil-substituídos pertencentes aos grupos 13-15. O número entre parênteses indica o ano da síntese. Crédito:Universidade de Kanazawa
Tetrafenilamônio, com todos os quatro hidrogênios de amônio (NH
4
+
) substituído por anéis de benzeno, não foi descoberto na natureza nem sintetizado quimicamente, questionando se poderia existir. Aqui, conseguimos sintetizar tetrafenilamônio pela primeira vez, demonstrando sua existência estável. A estratégia sintética utilizada neste estudo, acoplamento radical, pode ser aplicável à síntese de vários amônios relacionados com alta novidade estrutural. O estudo foi publicado na
Nature Communications .
Como o anel benzênico é um constituinte representativo dos compostos orgânicos, uma estrutura que consiste apenas de um elemento comum mais o anel benzênico é considerada um dos esqueletos químicos mais fundamentais. Devido à sua importância, a síntese química de tais moléculas tem sido estudada desde os primórdios da química orgânica. Por exemplo, a estrutura na qual quatro anéis de benzeno estão ligados a um elemento representativo (boro, carbono, alumínio, silício ou fósforo) dos grupos 13 a 15 na tabela periódica (Fig. 1) foi sintetizada há mais de 70 anos, e o relatório sintético mais antigo data de 137 anos.
Esses esqueletos são coletivamente chamados de "tetrafenil", o que significa que a estrutura contém 4 anéis de benzeno. Quando o elemento central é nitrogênio, amônio, NH
4
+
, é considerado como o íon pai. Tal composto é chamado tetrafenilamónio. Este composto, na verdade um íon, tem uma estrutura química muito simples que até mesmo um iniciante em química orgânica pode imaginar facilmente.
No entanto, provou ser muito difícil criar artificialmente essa estrutura, e nenhum relatório sintético com identificação clara da estrutura foi publicado. Além disso, como não foi descoberto na natureza, não ficou claro até agora se o tetrafenilamônio pode existir. Surgiram publicações que assumem sua existência e mencionam apenas seu uso sem descrever sua síntese ou método de aquisição. Os bancos de dados compostos contêm apenas a estrutura química. Assim, este íon às vezes é referido como se já fosse conhecido. No entanto, na realidade, ninguém realmente o observou, tornando o tetrafenilamônio um "íon fantasma".
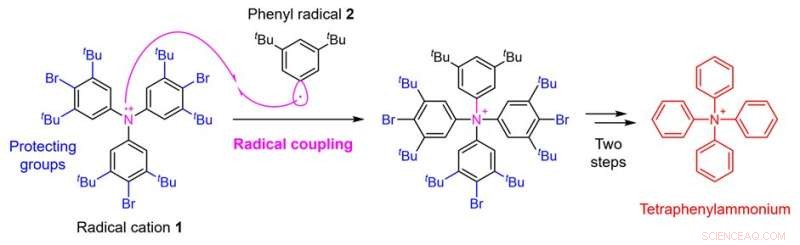
Figura 2. Estratégia de síntese de tetrafenilamônio usando acoplamento radical. Crédito:Universidade de Kanazawa
Neste estudo, uma equipe de pesquisa da Faculdade de Ciências Farmacêuticas da Universidade de Kanazawa permitiu a síntese de tetrafenilamônio estabelecendo uma nova estratégia sintética. O ponto crítico na síntese do tetrafenilamônio é a adição do quarto grupo fenil ao átomo de nitrogênio que já possui três grupos fenil ligados. Pensava-se ser difícil conseguir esta síntese com técnicas convencionais. No presente estudo, portanto, a equipe de pesquisa aplicou uma técnica chamada acoplamento radical e usou uma estratégia de reação do cátion radical 1 preparado a partir de um derivado de trifenilamina com o radical fenil 2 (Fig. 2).
Como resultado, embora o rendimento tenha sido tão baixo quanto 0,1%, a equipe de pesquisa conseguiu realizar a conversão química desejada. Em tais acoplamentos radicais, radicais altamente reativos formam ligações entre si, o que tem a vantagem de permitir a formação de ligações que não poderiam ser alcançadas por outros métodos. Por outro lado, tem a desvantagem de ser difícil controlar a seletividade porque a reatividade é muito alta, levando a várias reações colaterais.
Portanto, nesta síntese, a fim de suprimir tanto quanto possível a reação lateral de formação de ligações no carbono do radical cátion 1, a equipe de pesquisa também idealizou a introdução de grupos protetores) que causam impedimento estérico. Por fim, um total de cinco etapas de conversão química de um conhecido derivado de trifenilamina, material de partida para a síntese, foram realizadas através da introdução dos grupos protetores, acoplamento radical e posterior remoção dos grupos protetores, levando ao tetrafenilamônio.

Figura 3. Estrutura cristalina de raios-X do tetrafenilamônio. Crédito:Universidade de Kanazawa
Com base nos dados obtidos de várias análises instrumentais, a estrutura do tetrafenilamónio foi confirmada. cristalografia de raios X) revelou que o comprimento da ligação entre o átomo de nitrogênio e o átomo de carbono do grupo fenil contido neste íon é de apenas 1,529 Å (Fig. 3).
Uma vez que este comprimento de ligação é menor do que o de uma estrutura tetrafenil contendo outro elemento (boro, carbono, alumínio, silício ou fósforo), é evidente que o átomo de nitrogênio do tetrafenilamônio está em um ambiente mais espacialmente impedido do que outros elementos. Esse impedimento tridimensional é considerado um dos fatores que dificultam a construção desse esqueleto. Além disso, nossos resultados também revelaram que o tetrafenilamônio tem uma alta estabilidade para resistir a condições fortemente ácidas e básicas.
O presente estudo demonstrou que o tetrafenilamônio de fato existe e pode ser sintetizado quimicamente. Se a síntese em larga escala deste íon e seus derivados for realizada no futuro, ele poderá ser aplicado em vários campos de pesquisa como um cátion orgânico com alta estabilidade química. Além disso, a estratégia de acoplamento radical usada neste estudo pode ser aplicável à síntese de outros amônios relacionados que não puderam ser feitos até agora.
+ Explorar mais Formação de radical aril por clivagem de ligação haleto de aril por um catalisador de carbeno N-heterocíclico


