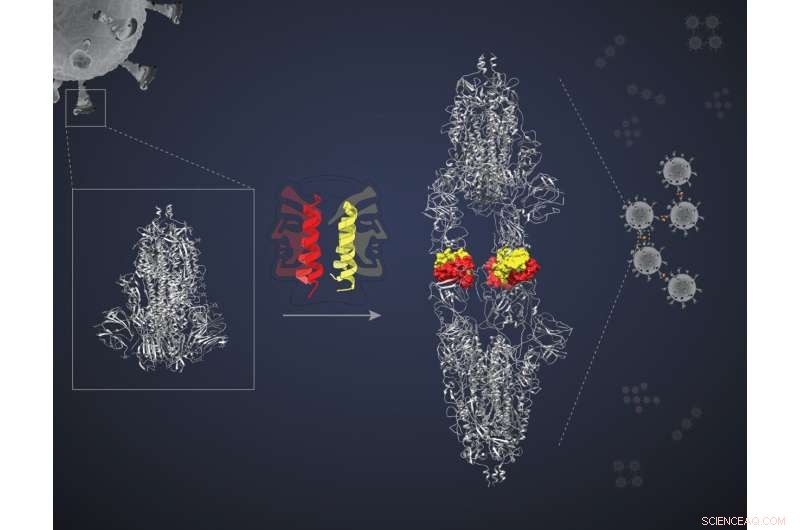
Dimerização da proteína spike por 'peptídeo de duas faces'. Crédito:Bhavesh Khatri
O rápido surgimento de novas cepas do vírus SARS-CoV-2 diminuiu a proteção oferecida pelas vacinas COVID-19. Uma nova abordagem desenvolvida por pesquisadores do Indian Institute of Science (IISc) agora fornece um mecanismo alternativo para tornar inativos vírus como o SARS-CoV-2.
Em um estudo publicado na
Nature Chemical Biology , os pesquisadores relatam o projeto de uma nova classe de peptídeos artificiais ou miniproteínas que podem não apenas bloquear a entrada de vírus em nossas células, mas também agrupar virions (partículas de vírus), reduzindo sua capacidade de infectar.
Uma interação proteína-proteína é muitas vezes como a de uma fechadura e uma chave. Essa interação pode ser dificultada por uma miniproteína feita em laboratório que imita, compete e impede que a "chave" se ligue à "cadeia" ou vice-versa.
No novo estudo, a equipe explorou essa abordagem para projetar miniproteínas que podem se ligar e bloquear a proteína spike na superfície do vírus SARS-CoV-2. Esta ligação foi ainda caracterizada extensivamente por microscopia crio-eletrônica (crio-EM) e outros métodos biofísicos.
Essas miniproteínas são peptídeos helicoidais em forma de grampo, cada um capaz de se emparelhar com outro de seu tipo, formando o que é conhecido como dímero. Cada "pacote" dimérico apresenta duas "faces" para interagir com duas moléculas alvo. Os pesquisadores levantaram a hipótese de que as duas faces se ligariam a duas proteínas-alvo separadas, bloqueando todas as quatro em um complexo e bloqueando a ação dos alvos. "Mas precisávamos de uma prova de princípio", diz Jayanta Chatterjee, Professor Associado da Unidade de Biofísica Molecular (MBU), IISc, e principal autor do estudo. A equipe decidiu testar sua hipótese usando uma das miniproteínas chamadas SIH-5 para direcionar a interação entre a proteína Spike (S) do SARS-CoV-2 e a proteína ACE2 em células humanas.
A proteína S é um trímero — um complexo de três polipeptídeos idênticos. Cada polipeptídeo contém um Domínio de Ligação ao Receptor (RBD) que se liga ao receptor ACE2 na superfície da célula hospedeira. Essa interação facilita a entrada viral na célula.
A miniproteína SIH-5 foi projetada para bloquear a ligação do RBD ao ACE2 humano. Quando um dímero SIH-5 encontra uma proteína S, uma de suas faces se liga firmemente a um dos três RBDs no trímero de proteína S e a outra face se liga a um RBD de uma proteína S diferente. Esta "reticulação" permitiu que a miniproteína bloqueasse ambas as proteínas S ao mesmo tempo. "Vários monômeros podem bloquear seus alvos", diz Chatterjee. "[Mas] a ligação cruzada de proteínas S bloqueia sua ação muitas vezes mais efetivamente. Isso é chamado de efeito de avidez."
Sob crio-EM, as proteínas S visadas pelo SIH-5 pareciam estar ligadas cabeça a cabeça. "Esperávamos ver um complexo de um trímero de pico com peptídeos SIH-5. Mas vi uma estrutura muito mais alongada", diz Somnath Dutta, professor assistente da MBU e um dos autores correspondentes. Dutta e os outros perceberam que as proteínas spike estavam sendo forçadas a formar dímeros e se aglomeravam em complexos com a miniproteína. Esse tipo de aglomeração pode inativar simultaneamente várias proteínas de pico do mesmo vírus e até mesmo várias partículas de vírus. "Eu trabalhei com anticorpos criados contra a proteína spike antes e os observei sob um crio-EM. Mas eles nunca criaram dímeros dos spikes", diz Dutta.
A miniproteína também foi considerada termoestável – pode ser armazenada por meses à temperatura ambiente sem se deteriorar.
O próximo passo foi perguntar se o SIH-5 seria útil para prevenir a infecção por COVID-19.
Para responder a isso, a equipe primeiro testou a miniproteína quanto à toxicidade em células de mamíferos no laboratório e descobriu que era segura. Em seguida, em experimentos realizados no laboratório de Raghavan Varadarajan, professor da MBU, os hamsters foram dosados com a miniproteína, seguidos pela exposição ao SARS-CoV-2. Esses animais não apresentaram perda de peso e diminuíram bastante a carga viral, além de muito menos danos às células nos pulmões, em comparação com os hamsters expostos apenas ao vírus.
Os pesquisadores acreditam que, com pequenas modificações e engenharia de peptídeos, essa miniproteína feita em laboratório também pode inibir outras interações proteína-proteína.
+ Explorar mais Projetando inibidores de peptídeos para possíveis tratamentos com COVID-19
