Morte celular programada em células cancerígenas:superando a resistência por meio de compostos indutores de paraptose
Pesquisadores da Universidade de Ciência de Tóquio desenvolveram novos híbridos complexos de peptídeos, que podem induzir um tipo de morte celular programada chamada “paraptose” em células cancerígenas resistentes à apoptose. Crédito:Universidade de Ciências de Tóquio
A apoptose, um tipo de morte celular programada (PCD), é um processo biológico pelo qual células indesejadas são eliminadas em organismos multicelulares. Na maioria das células, certas proteínas conhecidas como "caspases" desencadeiam a apoptose. Este processo é especialmente importante para o tratamento do câncer, uma vez que induzir a morte celular nas células cancerosas pode ajudar na sua eliminação.
Além da apoptose, vários tipos de PCDs ocorrem nas células, incluindo paraptose, necroptose e autofagia. Destes, a paraptose é o tipo de PCD mais recentemente identificado, que é causado pelo influxo de excesso de cálcio nas células, levando à morte celular.
As células cancerosas muitas vezes se tornam resistentes a drogas que induzem apoptose e outros tipos de PCDs. Nesses casos, a indução de paraptose, que não depende de caspases, pode atuar como um tratamento anticancerígeno promissor. Assim, o desenvolvimento de compostos que podem induzir paraptose em células cancerosas é crucial.
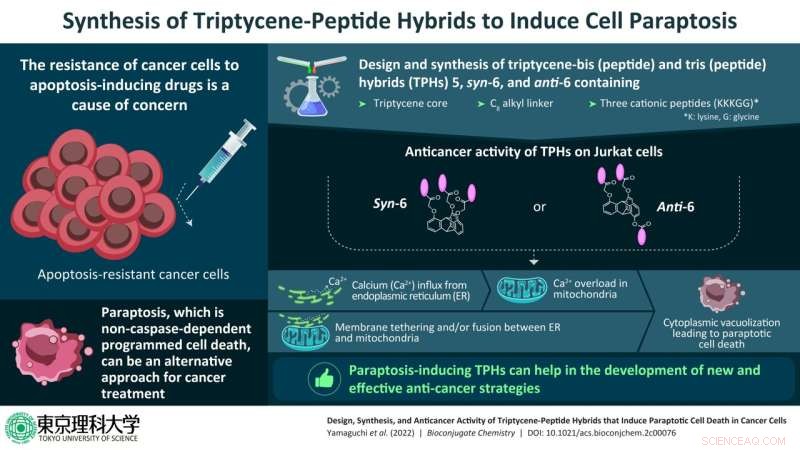
Para este fim, uma equipe de pesquisadores da Universidade de Ciência de Tóquio, liderada pelo Prof. Shin Aoki em colaboração com o Sr. Kohei Yamaguchi e o Dr. Kenta Yokoi, realizou um estudo para desenvolver novos híbridos complexos-peptídeos com potencial de indução de paraptose. Este estudo foi publicado em
Bioconjugate Chemistry .
"Anteriormente, sintetizamos um composto híbrido complexo de irídio-peptídeo e observamos que ele induzia a morte celular em células cancerígenas, o que era diferente da apoptose. Como esse composto era diferente de outros compostos indutores de paraptose, queríamos entender seu mecanismo de indução de paraptose. Nosso objetivo agora é sintetizar novos compostos e elucidar como eles induzem paraptose nas células, antes de compartilharmos essas informações cruciais com o público”, explica o Prof. Aoki ao discutir a motivação da equipe por trás deste estudo.
Os compostos recém-sintetizados eram compostos por um núcleo tripticeno - um hidrocarboneto aromático - com dois ou três peptídeos catiônicos feitos dos aminoácidos lisina e glicina (representados como KKKGG) através de um C
8 cadeia ligante de alquila, em diferentes posições das unidades tripticenos. Como resultado, três híbridos triptycene core (TPHs) foram produzidos, a saber, 5, syn-6 e anti-6.
A equipe posteriormente realizou experimentos em células Jurkat, um tipo de linfócitos humanos imortalizados usados em pesquisas, para entender o tipo de PCD que ocorreu nessas células em tratamento com syn-6 e anti-6. Eles descobriram que a morte nessas células foi inibida pelo cianeto de carbonil m-clorofenil hidrazona (CCCP), que é um reagente de desacoplamento e um inibidor da absorção de cálcio mitocondrial, RuRed, que é um inibidor do canal de cálcio mitocondrial) e borato de 2-aminoetoxidifenil (2-APB), que é um inibidor do receptor D-inositol-1,4,5-trifosfato. No entanto, a morte celular não foi inibida pelos inibidores dos outros tipos de PCDs.
Assim, eles descartaram autofagia, necroptose e apoptose, confirmando que a paraptose é uma importante via de PCD induzida por syn-6 e anti-6 em células Jurkat.
"Estudos indicam que os TPHs syn-6 e anti-6 induzem a transferência do excesso de cálcio do retículo endoplasmático (RE) para as mitocôndrias, resultando em perda do potencial de membrana mitocondrial. a fusão do ER com a mitocôndria, seguida de vacuolização citoplasmática, resultando em morte celular", disse o Prof. Aoki, quando perguntado por que esses dois TPHs foram selecionados para o estudo. Os TPHs syn-6 e anti-6 são mais hidrofílicos do que outros TPHs, o que também pode ser uma razão para seu alto potencial anticancerígeno indutor de paraptose.
Por meio de experimentos de imagem adicionais, a equipe detectou a presença de vacuolização citoplasmática, concentrações elevadas de cálcio mitocondrial e a degradação do ER em células Jurkat tratadas com syn-6 e anti-6.
Com base em descobertas anteriores, a equipe levantou a hipótese de que também nas células Jurkat, o influxo de cálcio nas mitocôndrias pode ser facilitado pela proximidade do ER e das mitocôndrias. Como esperado, eles descobriram que o RE e as membranas mitocondriais estavam ligadas uma à outra, facilitando a transferência direta de cálcio.
Esses achados confirmaram que as células Jurkat tratadas com syn-6 e anti-6 sofreram morte celular programada, devido à paraptose. Eles também fornecem informações cruciais para o projeto de compostos que podem ser usados como agentes terapêuticos contra o câncer e outras doenças.
+ Explorar mais Um metalopeptídeo tem como alvo e interrompe a função mitocondrial nas células-tronco do câncer de mama
