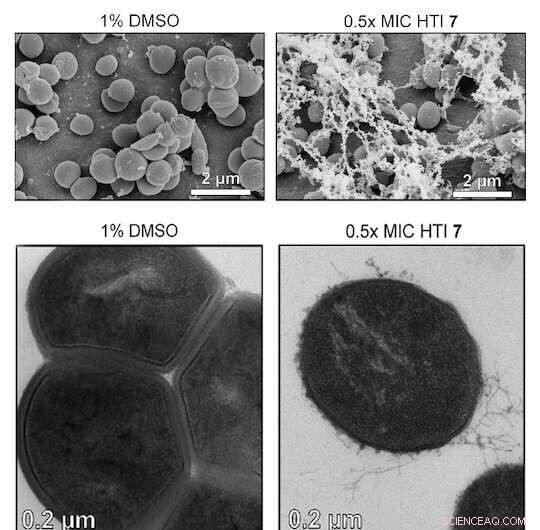
Crédito:Ciências Avançadas (2022). DOI:10.1002/advs.202203242
Uma nova classe de moléculas motorizadas que matam bactérias específicas mostra-se promissora para conter a ameaça da resistência a antibióticos à saúde humana.
Cientistas da Rice University lideraram uma equipe que desenvolveu moléculas de hemitioindigo ativado por luz (HTI) que destroem bactérias Gram-positivas e os biofilmes que elas formam. As moléculas fazem isso aumentando a geração local de espécies reativas de oxigênio (ROS) que atacam e destroem quimicamente células resistentes a drogas.
As novas moléculas diferem e são complementares a outras criadas em Rice que também são ativadas pela luz, mas perfuram as membranas celulares para matá-las.
Como os exercícios baseados no trabalho vencedor do Prêmio Nobel de Bernard Feringa, as moléculas baseadas em HTI são ativadas pela luz visível em vez da radiação ultravioleta prejudicial.
Ambos são produtos do químico de arroz James Tour e seus colegas. A ex-alunos da Rice, Ana Santos, pós-doutoranda global no Instituto de Pesquisa em Saúde das Ilhas Baleares em Palma, Espanha, e Alexis van Venrooy, agora cientista sênior da Genesis Therapeutics, San Diego, são co-autores principais do novo estudo em
Ciências Avançadas .
As máquinas moleculares baseadas em HTI consistem em duas metades:uma unidade de tioíndigo ligada a um carbociclo através de uma ligação dupla de carbono central. Quando acionada pela luz visível, a molécula sofre uma mudança conformacional que resulta em um movimento de 360 graus semelhante a uma broca ou uma mudança entre duas conformações, como um interruptor "ligar/desligar", dependendo do design molecular.
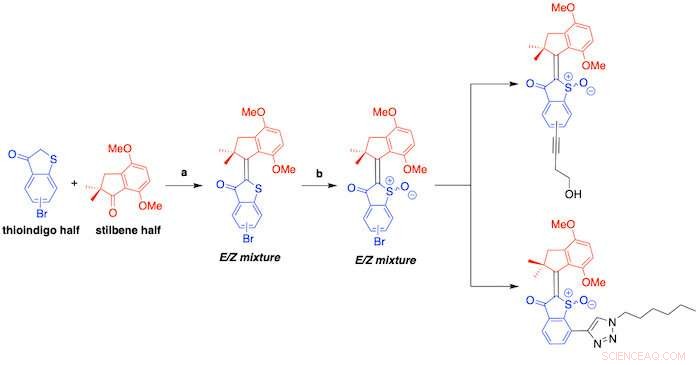
Um esquema mostra a síntese de hemitioíndigos descritos em um novo estudo liderado por pesquisadores da Rice. Os motores moleculares são acionados pela luz visível e matam bactérias nocivas gerando espécies reativas de oxigênio. Crédito:The Tour Group
No processo, HTIs ativados reagem com a célula e o oxigênio molecular, transferindo elétrons para produzir ROS que atingem as células-alvo.
"Estes não estão matando as células rasgando mecanicamente as membranas como as anteriores", disse Tour. "Eles induzem a ruptura suficiente para que espécies reativas de oxigênio e radicais livres sejam gerados e acabem matando as células.
"Então não é a morte necrótica rápida que vimos antes", disse ele. "É um pouco mais lento, mas é extremamente eficiente."
"Uma vantagem importante dessas moléculas é que elas têm um espectro estreito de atividade e matam seletivamente um grupo específico de bactérias, as bactérias Gram-positivas", disse Santos. "Portanto, eles são menos propensos a causar os efeitos colaterais observados com antibióticos de amplo espectro que matam indiscriminadamente bactérias 'ruins' e 'boas', e também são menos propensos a levar à resistência porque apenas um grupo de bactérias é afetado. "
As bactérias Gram-positivas não possuem uma membrana externa (embora tenham uma camada espessa de peptidoglicano), e isso parece torná-las mais suscetíveis a ROS que oxidam e quebram suas paredes celulares.
Os pesquisadores testaram várias variantes de HTI em sete cepas de bactérias Gram-positivas e descobriram que a molécula matou todas elas na presença de luz. (HTIs foram menos eficazes em bactérias Gram-negativas, presumivelmente porque sua membrana dupla impede HTI de entrar na célula. Mas permeabilizá-los com uma solução tampão Tris-EDTA os tornou mais propensos a serem mortos por HTIs.)
Eles também expuseram colônias de Staphylococcus aureus com e sem a presença de ROS scavengers e descobriram que aqueles com scavengers reduziram a eficácia das moléculas de hemitioindigo. Sem scavengers, o ROS teve o efeito desejado nas bactérias.
O estudo mostrou que os HTIs também mataram células persistentes tolerantes a antibióticos de diferentes cepas Gram-positivas em menos de 25 minutos, mais rápido que os antibióticos convencionais. Em todos os casos, a exposição repetida a HTIs não aumentou a resistência da bactéria ao tratamento.
Como o tratamento é baseado em ROS e não em ação mecânica, não prejudica as células de mamíferos, disse Santos. "Isso abre caminho para uma nova terapia antimicrobiana que pode atingir com segurança patógenos Gram-positivos associados a infecções de pele, como queimaduras", disse ela.
“Os resultados também ajudam a aprofundar nossa compreensão das máquinas moleculares em geral, mostrando que nem todas agem pelos mesmos mecanismos e que diferenças no núcleo químico da molécula podem resultar em ações biológicas muito diferentes”.
+ Explorar mais As nanobrocas que matam bactérias recebem uma atualização:a luz visível aciona máquinas moleculares para tratar infecções

