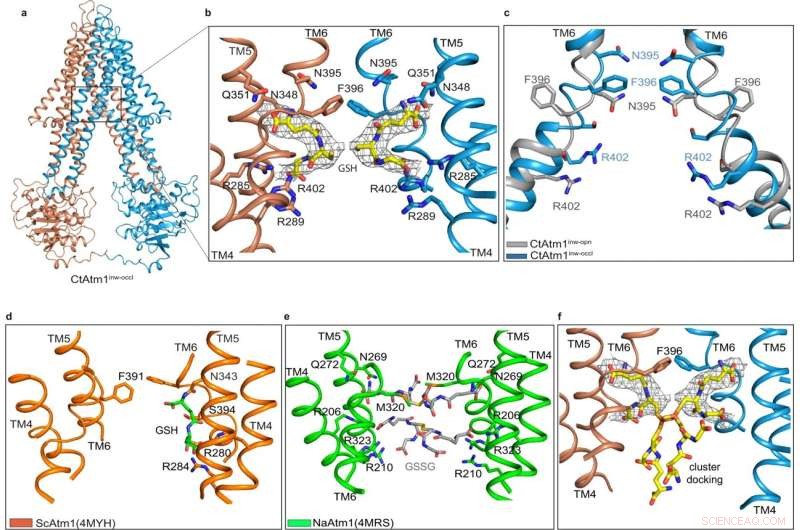
A estrutura parcialmente ocluída voltada para dentro com carga vinculada. Crédito:Comunicação da Natureza (2022). DOI:10.1038/s41467-022-32006-8
Novas pesquisas fornecem novos insights sobre como uma importante classe de moléculas é criada e movida em células humanas.
Durante anos, os cientistas sabiam que as mitocôndrias – estruturas especializadas dentro das células do corpo que são essenciais para a respiração e a produção de energia – estavam envolvidas na montagem e no movimento de cofatores ferro-enxofre, alguns dos compostos mais essenciais do corpo humano. Mas até agora, os pesquisadores não entendiam como exatamente o processo funcionava.
Nova pesquisa, publicada na revista
Nature Communications , descobriram que esses cofatores são movidos com a ajuda de uma substância chamada glutationa, um antioxidante que ajuda a prevenir certos tipos de danos celulares, transportando esses cofatores essenciais de ferro através de uma barreira de membrana.
A glutationa é especialmente útil, pois ajuda na regulação de metais como o ferro, que é usado pelos glóbulos vermelhos para produzir hemoglobina, uma proteína necessária para ajudar a transportar oxigênio por todo o corpo, disse James Cowan, coautor do estudo e distinto professor universitário. emérito em química e bioquímica no estado de Ohio.
"Os compostos de ferro são críticos para o bom funcionamento da bioquímica celular, e sua montagem e transporte é um processo complexo", disse Cowan. "Determinamos como uma classe específica de cofatores de ferro é movida de um compartimento celular para outro pelo uso de maquinaria molecular complexa, permitindo que eles sejam usados em várias etapas da química celular".
Os aglomerados de ferro-enxofre são uma importante classe de compostos que realizam uma variedade de processos metabólicos, como ajudar a transferir elétrons na produção de energia e fazer metabólitos-chave na célula, além de auxiliar na replicação de nossa informação genética.
"Mas quando esses aglomerados não funcionam corretamente, ou quando as proteínas-chave não conseguem obtê-los, coisas ruins acontecem", disse Cowan.
Se incapaz de funcionar, a proteína corrompida pode dar origem a várias doenças, incluindo formas raras de anemia, ataxia de Friedreich (um distúrbio que causa danos progressivos ao sistema nervoso) e uma infinidade de outros distúrbios metabólicos e neurológicos.
Então, para estudar como esse mecanismo essencial funciona, os pesquisadores começaram pegando um fungo chamado C. thermophilum, identificando a molécula-chave da proteína de interesse e produzindo grandes quantidades dessa proteína para determinação estrutural. O estudo observa que a proteína que eles estudaram dentro de C. thermophilum é essencialmente um gêmeo celular da proteína humana ABCB7, que transfere aglomerados de ferro-enxofre em pessoas, tornando-o o espécime perfeito para estudar a exportação de aglomerados de ferro-enxofre em pessoas.
Usando uma combinação de microscopia crioeletrônica e modelagem computacional, a equipe conseguiu criar uma série de modelos estruturais detalhando o caminho que as mitocôndrias usam para exportar os cofatores de ferro para diferentes locais dentro do corpo. Embora suas descobertas sejam vitais para aprender mais sobre os blocos de construção básicos da bioquímica celular, Cowan disse que está animado para ver como sua descoberta poderia avançar na medicina e na terapêutica.
"Ao entender como esses cofatores são montados e movidos nas células humanas, podemos estabelecer as bases para determinar como prevenir ou aliviar os sintomas de certas doenças", disse ele. "Também podemos usar esse conhecimento fundamental como base para outros avanços na compreensão da química celular".
+ Explorar mais Insights estruturais sobre a biogênese da proteína Fe-S
