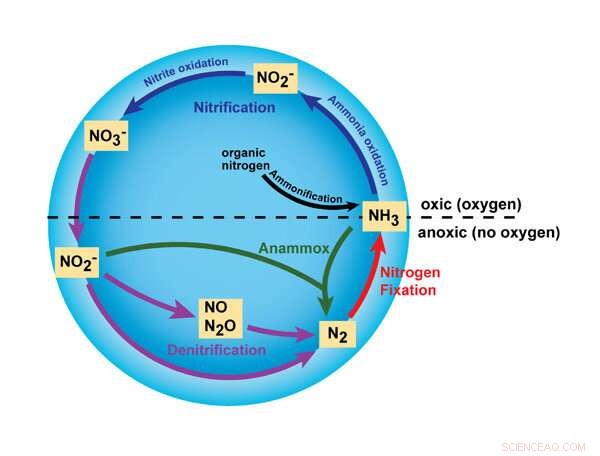
Este gráfico destaca algumas das principais reações no ciclo do nitrogênio, iniciadas pelo uso de amônia, ou NH3 , fertilizantes. A nova pesquisa da MSU amplia as reações envolvendo nitrito (NO2 -), óxido nítrico (NO) e óxido nitroso (N2 O). Direitos autorais: Nature Education, 2010
O nitrogênio pode não receber o mesmo nível de atenção que seus vizinhos na tabela periódica, carbono e oxigênio. Mas, como seus vizinhos, é um elemento sem o qual não podemos viver.
Os compostos de nitrogênio têm papéis importantes na biologia, incluindo a redução da pressão arterial, ajudando a transmitir sinais em nossos corpos e fornecendo nutrição para as plantas. De fato, fertilizantes industrializados ricos em nitrogênio efetivamente dobraram a capacidade mundial de cultivo de alimentos.
No entanto, muito de qualquer coisa pode ser ruim, e o nitrogênio não é exceção. Por exemplo, quando a chuva leva o excesso de fertilizante dos campos para lagos, rios e outros corpos d'água, os compostos nutritivos contidos neles podem alimentar populações crescentes de micróbios que podem sufocar ou envenenar os ecossistemas naturais.
Subjacente aos impactos do nitrogênio, úteis e prejudiciais, está o que é conhecido como ciclo do nitrogênio. Esse é o nome coletivo para os processos químicos que os sistemas biológicos e geológicos da natureza usam para decompor os compostos de nitrogênio e transportar os produtos pelo meio ambiente. Embora a ciência tenha desenvolvido grande parte do quadro geral do ciclo do nitrogênio, Timothy Warren, da Michigan State University, e sua equipe agora estão se aprofundando em seus detalhes químicos fundamentais.
A equipe divulgou recentemente dois novos relatórios sobre essa frente em duas revistas de química diferentes:
Nature Chemistry e o
Jornal da Sociedade Americana de Química (
JACS ).
O que Warren e sua equipe descobriram recentemente não fornecerá soluções imediatas para, digamos, fabricar e usar fertilizantes de maneira mais sustentável. Mas os pesquisadores estão criando uma compreensão mais íntima do ciclo do nitrogênio que pode levar a soluções holísticas para garantir um equilíbrio saudável de nitrogênio, onde quer que seja necessário.
Enquanto isso, os papéis também servem como um lembrete de que a natureza ainda está cheia de mistérios conseqüentes – alguns dos quais são anteriores a pessoas e plantas.
"Estamos muito inspirados pelo que encontramos na natureza, mas estamos tentando entender como a natureza se comporta que ainda não percebemos", disse Warren, professor Barnett Rosenberg e presidente do Departamento de Química em a Faculdade de Ciências Naturais.
"Existe o dogma estabelecido de como as coisas funcionam, mas cavando um pouco mais fundo e tentando ir além disso, abrimos a ciência para surpresas."
Além de revelar algumas novas revelações, ambos os artigos ajudam a descrever o ciclo do nitrogênio com mais detalhes e precisão do que era possível anteriormente. Apesar de suas semelhanças, eles também vêm com diferentes conjuntos de implicações.
Química primordial com 'nitro boost' Correndo o risco de simplificar demais todo um campo científico, a química está preocupada com a forma como os átomos são trocados e rearranjados quando diferentes participantes moleculares estão envolvidos. Algumas das interações mais intrigantes são aquelas que são essenciais para a vida, aquelas que melhoram nossa qualidade de vida ou aquelas que ajudam os cientistas a entender melhor como a vida neste planeta funciona.
As reações do ciclo do nitrogênio podem marcar todas as três caixas, conforme evidenciado pelos destacados nos documentos da equipe de Warren.
"Esses dois relatórios fornecem novos insights fundamentais sobre moléculas que são partes importantes do ciclo biogeoquímico do nitrogênio. Esse ciclo é fundamental para que os ecossistemas funcionem e sejam saudáveis", disse Warren. "O que estamos fazendo é examinar as moléculas de novas maneiras para entender melhor sua conexão com esse ciclo".
Em particular, o artigo JACS da equipe ilumina um novo caminho que a natureza pode usar para converter óxido nítrico em óxido nitroso, que são moléculas importantes em seus próprios direitos.
O óxido nítrico, feito de um átomo de nitrogênio e um átomo de oxigênio, foi nomeado "Molécula do Ano" em 1992 pela revista Science. E as pessoas podem reconhecer o óxido nitroso, que contém dois átomos de nitrogênio e um oxigênio, de seu papel de protagonista no gás hilariante ou seu papel coadjuvante como "nitro boost" na franquia de filmes "Velozes e Furiosos".
Mais uma vez, a equipe de Warren está ciente das aplicações das moléculas, mas os pesquisadores são motivados pelo que essas reações revelam em um nível químico mais fundamental. O
JACS papel, por exemplo, revela que o óxido nítrico é surpreendentemente hábil em aceitar elétrons de outros reagentes.
Sob as condições certas, o óxido nitroso também pode ser um bom aceptor de elétrons, mas o oxigênio fornece um padrão firme nessa arena. É por isso que os químicos se referem a esses compostos aceitadores de elétrons como oxidantes, oxidantes e agentes oxidantes. Os oxidantes são famosos por causar ferrugem no metal, mas também são críticos para muitas reações biológicas e industriais importantes.
Mas o oxigênio não era uma mercadoria prontamente disponível na atmosfera da Terra até que o planeta tivesse alguns bilhões de anos. Foi quando os primeiros micróbios começaram a emiti-lo, com as plantas mais tarde seguindo o exemplo através da fotossíntese.
"A natureza estava fazendo química de oxidação antes do Grande Evento de Oxidação, antes do início da fotossíntese", disse Warren. "Isso significa que tanto o óxido nítrico quanto os compostos de nitrogênio relacionados provavelmente eram oxidantes importantes na vida primordial, antes que a Terra tivesse muito oxigênio.
"Acontece que a natureza desenvolveu enzimas que podem fazer essa química de oxidação com esses compostos", disse ele. "Este artigo fornece novos insights sobre como a natureza os usa hoje e talvez antes mesmo de o oxigênio ser abundante."
A história de uma molécula quebrada A
Nature Chemistry da equipe O artigo concentrou-se em uma parte diferente do ciclo do nitrogênio, que começa com um composto conhecido como nitrito, uma molécula carregada negativamente que consiste em um átomo de nitrogênio ligado a dois átomos de oxigênio.
O nitrito aparece em muitos lugares, muitos dos quais refletem a dualidade do nitrogênio. O nitrito está em fertilizantes que ajudam as plantas a crescer. É também no escoamento que polui os ecossistemas aquáticos.
O nitrito é encontrado naturalmente em níveis saudáveis em frutas e vegetais. Ao mesmo tempo, os médicos recomendam limitar o consumo de carnes processadas, nas quais os sais de nitrito são usados como conservantes em níveis comparativamente altos.
Quando se trata de nitrito, a divisão entre benefício e carga está ligada à dosagem, mas também em se e como é metabolizado ou convertido em outros compostos. Isso significa que, com uma melhor compreensão do ciclo do nitrogênio, a química pode ajudar a mitigar os efeitos nocivos do nitrito desenvolvendo enzimas ou outras ferramentas catalíticas que o colocam no caminho de produtos mais benéficos a jusante. Notavelmente, isso inclui o óxido nítrico, a "Molécula do Ano" de 1992.
Os micróbios do solo têm enzimas que convertem nitrito em óxido nítrico em um conjunto altamente coreografado de interações químicas que acontecem ao mesmo tempo. A equipe de Warren encontrou uma maneira de separar esse processo em um processo gradual e sequencial. Encontrar essa abordagem sintética para imitar a natureza permitirá que os químicos analisem melhor diferentes aspectos da reação.
Isso ajudará os químicos a serem mais deliberados no projeto de catalisadores que podem fazer coisas como ajudar a quebrar os nutrientes dos fertilizantes antes que eles atinjam os cursos d'água naturais. Também abre aplicações ainda mais distantes do papel do nitrogênio na natureza, disse Warren, como no armazenamento de longo prazo de resíduos nucleares onde os nitritos estão presentes. Em seu estudo, a equipe também descobriu uma nova química que poderia até ajudar a melhorar as notas de graduação.
"Em todo curso de química geral, seja na MSU ou em outro lugar, você aprende que o nitrito é um ânion com uma carga elétrica de -1. Mas se ele acidentalmente receber uma carga de -2, encontramos uma maneira isso mostra que isso também pode estar certo", disse Warren.
"Revelamos uma nova molécula fundamental na natureza:nitrito com carga -2. Não houve muita discussão sobre isso antes, exceto como uma espécie fugaz no lixo nuclear ou talvez quando os alunos erram nas provas."
+ Explorar mais Pesquisadores pedem mais trabalho para equilibrar o ciclo do nitrogênio
