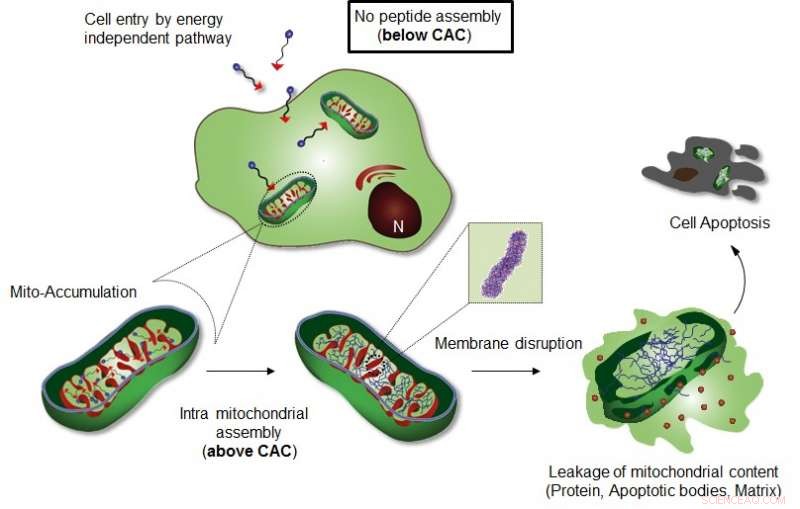
A Figura mostra a montagem intra-mitocondrial de Mito-FF. Crédito:UNIST
Montagem in situ de peptídeos anfifílicos com as funções celulares associadas dentro de uma célula viva (isto é, montagem intracelular) e sua interação com componentes celulares têm emergido como uma estratégia versátil no controle do destino celular. Contudo, alcançar o controle espaço-temporal (ou seja, dentro de organelas celulares ou outros subcompartimentos) sobre a automontagem de moléculas sintéticas dentro da célula é um desafio devido à dificuldade de estudar seus comportamentos no ambiente intracelular complexo.
Um estudo recente, afiliado ao UNIST desenvolveu um novo método para direcionar a mitocôndria de uma célula cancerosa. A equipe de pesquisa espera que seu estudo possa abrir caminho para uma nova geração de drogas anticâncer.
Esta pesquisa foi liderada pelo Professor Ja-Hyoung Ryu de Química da UNIST em colaboração com Sang Kyu Kwak da Engenharia de Energia e Química da UNIST e o Professor Eunji Lee da Escola de Graduação em Ciência Analítica e Tecnologia da Universidade Nacional de Chungam. Os resultados do estudo foram publicados na edição de 21 de abril do Nature Communications.
No estudo, a equipe de pesquisa conjunta apresentou, pela primeira vez, a auto-montagem localizada em organela de um peptídeo anfifílico como uma estratégia poderosa para controlar o destino celular.
A automontagem é um processo de equilíbrio entre as unidades de construção individuais e seu estado agregado, e a concentração das moléculas deve estar acima do valor crítico para induzir a montagem (isto é, a concentração crítica de agregação (CAC). Em células vivas, alcançar o CAC também é necessário para formar conjuntos de moléculas individuais, mas tem uma limitação porque a complexidade química dos ambientes celulares interrompe as interações entre as unidades de construção sintéticas.
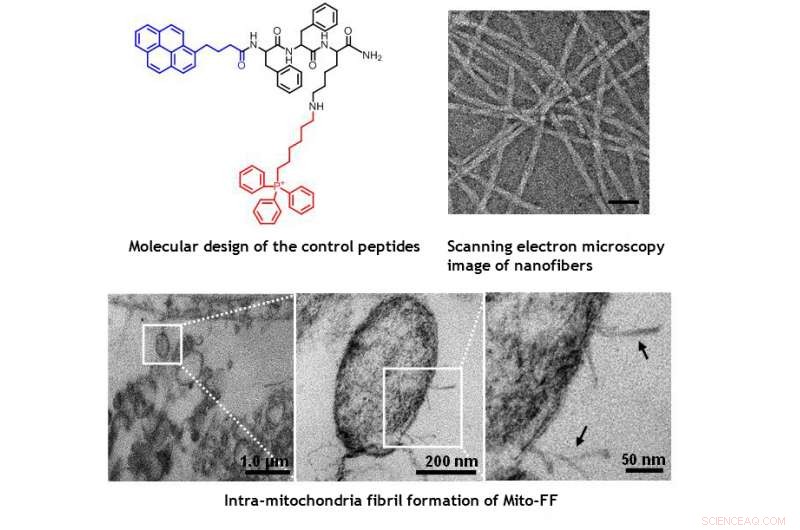
Imagens TEM de mitocôndrias dentro da célula HeLa mostrando o dano morfológico induzido por Mito-FF. Crédito:UNIST
Auto-montagem intracelular, portanto, requer uma concentração maior das moléculas do que o CAC, o que pode limitar as implementações práticas de moléculas de automontagem. Transformação da estrutura molecular de unidades hidrofílicas para hidrofóbicas dentro da célula (ou espaço pericelular) por meio de estímulos externos (químicos, ou físico) é uma estratégia poderosa para reduzir o CAC, aumentando a propensão para a automontagem. Contudo, estímulos químicos e físicos (por exemplo, luz, temperatura, pH, e redox) não são relevantes para a montagem intracelular porque induzem danos graves às células.
A equipe de pesquisa do professor Ryu introduziu um sistema de auto-montagem supramolecular induzida por localização de organela celular (OLISA) pode ser uma estratégia geral para induzir a auto-montagem, aumentando as concentrações locais das moléculas de auto-montagem sem tratamento adicional. As pequenas moléculas se difundem prontamente através da membrana celular, chegar ao local alvo (organela ou compartimento subcelular, dependendo da porção de direcionamento), e então eles sofrem automontagem dentro da organela alvo como resultado do aumento da concentração local. O acúmulo de moléculas dentro de uma organela como a mitocôndria é de aproximadamente 500-1, 000 vezes maior do que o do espaço extracelular.
"OLISA é uma estratégia mais geral e direta para alcançar a montagem intracelular e é inteiramente nova, é uma abordagem promissora para controlar o destino celular como a apoptose, proliferação celular etc. e é uma estratégia útil para suas investigações em profundidade ", diz o professor Ryu.
O projeto consiste em um peptídeo anfifílico que acumula mitocôndrias (Mito-FF), que consiste em difenilalanina como um bloco de construção formador de folha β, TPP como uma porção de direcionamento mitocondrial, e pireno como uma sonda fluorescente. O Mito-FF se acumulou favoravelmente na mitocôndria das células cancerosas por causa do alto potencial de membrana negativa e o aumento da concentração fez com que o Mito-FF se automontasse em uma estrutura fibrosa, enquanto a falta de formação de fibrilas foi observada em células normais. As fibrilas rígidas de Mito-FF destruíram a membrana mitocondrial e ativaram a via apoptótica intrínseca contra as células cancerosas. Este sistema OLISA oferece uma nova abordagem para quimioterapia direcionada ao câncer.
M.T. Jeena de Química na UNIST, o principal autor do estudo espera que o novo método defina as bases para uma nova série de tratamentos que podem maximizar o processo de cicatrização, minimizando os efeitos colaterais.