 p Resumo gráfico. Crédito:DOI:10.1038 / s41589-021-00841-3
p Resumo gráfico. Crédito:DOI:10.1038 / s41589-021-00841-3
p A colecistoquinina (CCK) e a gastrina são os primeiros hormônios gastrointestinais descobertos. Eles são os peptídeos mais abundantes no trato gastrointestinal e sistema nervoso central, agindo como hormônios e neurotransmissores fisiologicamente importantes por meio de dois subtipos de receptores CCK, CCKAR e CCKBR. p Esses dois receptores se envolvem em ações fisiológicas fundamentais, como a regulação da saciedade, secreção de enzima pancreática, e contração da vesícula biliar. Eles também estão implicados em processos comportamentais, incluindo ansiedade, memória, e dependência de drogas. Contudo, o desenvolvimento de drogas contra os receptores de colecistocinina (CCKRs) é desafiador principalmente devido à falta de informações estruturais precisas.
p Em dois estudos, ambos publicados em
Nature Chemical Biology , a equipe de pesquisa liderada por Jiang Yi, Wang Mingwei, H. Eric Xu, Zhao Qiang, e Wu Beili, do Instituto de Matéria Médica de Xangai, da Academia Chinesa de Ciências, e a equipe de pesquisa liderada por Zhao Suwen da Universidade ShanghaiTech, juntos revelaram os mecanismos de reconhecimento do ligante, ativação e especificidade de acoplamento de proteína G de CCKRs.
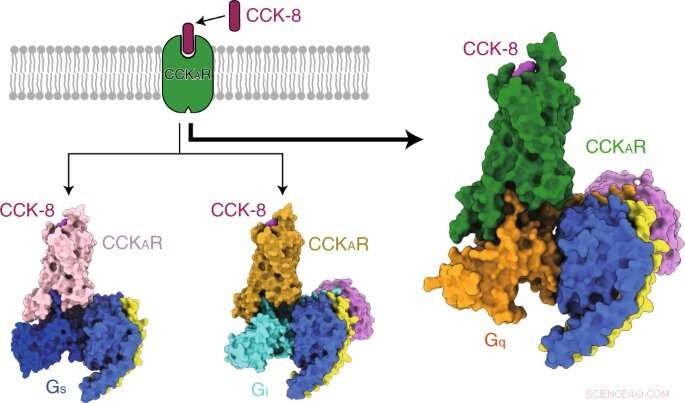
p Os pesquisadores primeiro resolveram três estruturas cristalinas do CCKAR humano em complexo com dois antagonistas de pequenas moléculas (lintitript e devazepida) e um agonista completo NN9056, bem como cinco estruturas de microscopia crioeletrônica (crio-EM) de CCKAR ativado por CCK-8 em complexo com três proteínas G (Gi, Gs, e Gq) e CCKBR ativado por gastrina acoplado a duas proteínas G (Gi e Gq). Eles elucidaram os mecanismos de reconhecimento de CCKRs por ligantes, Ativação de CCKRs, e promiscuidade da proteína G de CCKAR, todos os quais fornecem informações fundamentais para a descoberta de medicamentos de CCKRs.
p Os pesquisadores então apresentaram as estruturas de CCKAR sulfatado ligado ao CCKAR em complexo com Gq, Gs, e heterotrímeros Gi em resoluções globais de 2,9 angstrom, 3.1 angstrom, e 3.2 angstrom, respectivamente. Eles descobriram o modo de ligação do peptídeo endógeno CCK-8, e descobriram que a sulfo-tirosina em CCK-8 era crucial para a alta afinidade do peptídeo endógeno para CCKAR.
p Consistentemente, os pesquisadores descobriram que a proteína Gq mostrou a atividade de acoplamento mais potente do CCKAR. Esses resultados apoiaram Gq como o transdutor predominante de CCKAR e destacaram a importância da área de interface na seletividade de acoplamento da proteína G.
p Além disso, os pesquisadores relataram três estruturas cristalinas de CCKAR ligadas a pequenos antagonistas moleculares e um agonista peptídico, bem como duas estruturas crio-EM de complexos CCKBR acoplados a Gi- e Gq. Eles revelaram o modo de ligação de CCKRs por ligantes peptídicos e de pequenas moléculas, e identificou papéis essenciais no reconhecimento de CCKAR por devazepida e lintitript, fornecendo assim um modelo para a concepção de medicamentos visando CCKRs.
p Combinando as estruturas inativas e ativas do CCKAR com a análise de simulação molecular, os pesquisadores propuseram o processo de ativação gradual do CCKAR.
p As descobertas desses dois estudos ofereceram o primeiro insight sobre o reconhecimento do ligante e a ativação dos dois receptores CCK e forneceram uma nova oportunidade para o desenvolvimento de drogas direcionadas aos CCKRs.
