Os pesquisadores desenvolvem uma nova plataforma de espectroscopia Raman para caracterizar IDPs em solução diluída
 p Uma ilustração que mostra o ponto de acesso controlado por pinças ópticas para a caracterização estrutural da proteína por espectroscopia Raman de superfície aprimorada. Crédito:Vince St. Dollente Mesias, Jinqing Huang / Universidade de Ciência e Tecnologia de Hong Kong
p Uma ilustração que mostra o ponto de acesso controlado por pinças ópticas para a caracterização estrutural da proteína por espectroscopia Raman de superfície aprimorada. Crédito:Vince St. Dollente Mesias, Jinqing Huang / Universidade de Ciência e Tecnologia de Hong Kong
p É um desafio analisar proteínas em baixas concentrações, especialmente para aqueles em uma mistura de várias conformações, como proteínas intrinsecamente desordenadas (IDPs). Uma equipe de pesquisa liderada pelo Prof. Huang Jinqing, Professor Assistente do Departamento de Química da Universidade de Ciência e Tecnologia de Hong Kong (HKUST), desenvolveu espectroscopia Raman acoplada a pinças ópticas que pode sondar diretamente as características estruturais da alfa-sinucleína, um PDI intimamente ligado à doença de Parkinson, na concentração fisiológica, concentrando-se em moléculas de proteína individuais. p Os deslocados internos desempenham um papel importante nos processos biológicos e muitos deles estão associados a doenças neurodegenerativas incuráveis. Como um IDP típico, A alfa-sinucleína carece de uma arquitetura 3-D estável conhecida como estruturas secundárias. Ele passa espontaneamente por conversões de uma estrutura secundária para outra, o que poderia eventualmente resultar no acúmulo de agregados de proteínas envolvidos na patologia da doença de Parkinson. Contudo, as espécies transitórias durante a conversão possuem várias estruturas e existem em baixa população entre uma mistura de equilíbrio dinâmico. Portanto, suas características estruturais são geralmente enterradas sob os resultados de detecção de técnicas de medição tradicionais, que calcula a média dos sinais detectados a partir de grandes quantidades de amostra e longos tempos de detecção.
p No estudo, Prof. Huang e seus colaboradores integram pinças ópticas e espectroscopia Raman de superfície aprimorada (SERS) em uma nova plataforma para gerar aprimoramentos SERS sintonizáveis e reproduzíveis com sensibilidade de nível de molécula única em ambientes aquosos, a fim de caracterizar esses IDPs, mantendo sua heterogeneidade intrínseca com grande significado biológico. Especificamente, um ponto de acesso pode ser visualizado e controlado por pinças ópticas para permitir que as proteínas passem por uma câmara de fluxo microfluídico, o que torna conveniente ajustar os parâmetros de medição em tempo real para as caracterizações espectroscópicas in situ. Ele identifica diretamente as características estruturais das espécies transitórias de alfa-sinucleína entre seus monômeros predominantes na concentração fisiológica de 1 μM, reduzindo a média do conjunto em quantidade e no tempo, fornecendo uma visão profunda para compreender o início da agregação da proteína amilóide. Portanto, esta plataforma SERS tem grande potencial para revelar as informações estruturais dos deslocados internos na dinâmica, heterogêneo, e sistemas biológicos complexos.
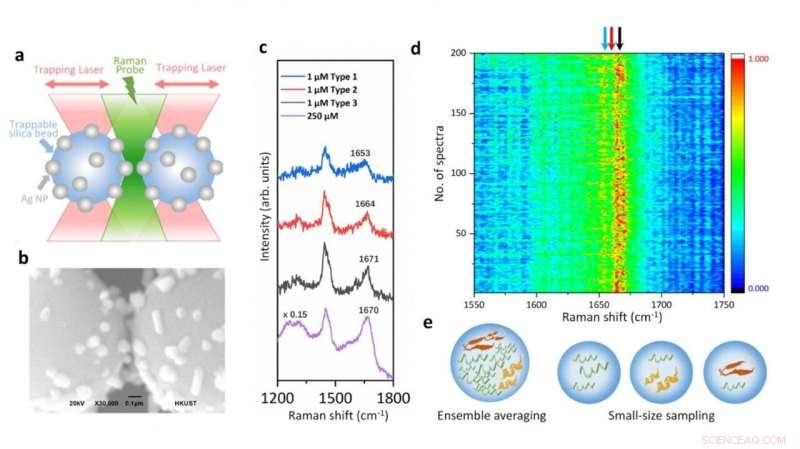 p Ilustração da plataforma de espectroscopia Raman acoplada a pinças ópticas e espectros SERS de alfa-sinucleína em concentração fisiológica, mostrando as variações estruturais decorrentes de suas espécies transitórias. Crédito:Vince St. Dollente Mesias, Jinqing Huang / Universidade de Ciência e Tecnologia de Hong Kong
p Ilustração da plataforma de espectroscopia Raman acoplada a pinças ópticas e espectros SERS de alfa-sinucleína em concentração fisiológica, mostrando as variações estruturais decorrentes de suas espécies transitórias. Crédito:Vince St. Dollente Mesias, Jinqing Huang / Universidade de Ciência e Tecnologia de Hong Kong
p "Nossa estratégia permite o controle preciso do ponto de acesso entre dois grânulos de sílica revestidos com nanopartículas de prata de tamanho micrométrico para melhorar a eficiência SERS e reprodutibilidade em detecções aquosas. Exceto para o aprimoramento SERS ajustável, as pinças ópticas integradas também oferecem resolução espacial sub-nanométrica e sensibilidade de força sub-piconewton para monitorar as interações luz-matéria no ponto de acesso plasmônico para uma visão física extra. Mais importante, nosso método abre uma nova porta para caracterizar as espécies transitórias de IDPs em soluções diluídas, que continua a ser um desafio significativo na comunidade biofísica. Em última análise, será emocionante explorar totalmente a manipulação de força precisa das pinças ópticas integradas para desdobrar uma única proteína dentro do ponto de acesso controlável e resolver sua dinâmica estrutural das vibrações moleculares endógenas pela espectroscopia Raman integrada, "disse o Prof. Huang.
p O estudo foi publicado recentemente na revista científica
Nature Communications .

