Ânions e solventes direcionam a nucleação e o crescimento da interfase de eletrólito sólido
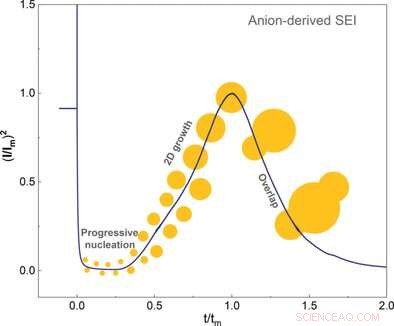 p © Wiley-VCH. Crédito:Angewandte Chemie International Edition doi.org/10.1002/anie.202100494
p © Wiley-VCH. Crédito:Angewandte Chemie International Edition doi.org/10.1002/anie.202100494
p As baterias são carregadas e recarregadas - aparentemente tudo graças a uma interação perfeita entre o material do eletrodo e o eletrólito. Contudo, para o funcionamento ideal da bateria, a interfase de eletrólito sólido (SEI) desempenha um papel crucial. Os cientistas de materiais já estudaram a nucleação e o crescimento dessa camada em detalhes atômicos. De acordo com o estudo publicado na revista
Angewandte Chemie , as propriedades dos ânions e das moléculas de solvente precisam ser bem equilibradas. p Em baterias de íon de lítio, os formulários SEI no início do primeiro processo de cobrança, quando um potencial é aplicado. Elementos do eletrólito se depositam no eletrodo de grafite e formam um revestimento que logo cobre todo o eletrodo. Só depois que essa camada for concluída, os íons de lítio positivos podem intercalar no eletrodo sem esfoliar o material do eletrodo.
p Qiang Zhang e colegas da Universidade Tsinghua, Pequim, China, agora demos uma olhada mais de perto na nucleação e crescimento do SEI. O eletrólito em baterias de íon-lítio contém sal de lítio e um solvente. Solventes fortemente solventes envolvem o íon de lítio, e os ânions flutuam livremente. Em contraste, eletrólitos de solvência fraca permitem uma ligação mais próxima dos ânions ao íon de lítio. Aqui, os ânions permanecem como parte da camada interna de solvatação.
p Esta camada de solvatação interna deve ser removida do lítio para permitir a formação e o crescimento de SEI. Os pesquisadores demonstraram que os ânions da camada interna primeiro são adsorvidos no eletrodo novo e, em seguida, absorvem dois elétrons em uma reação eletroquímica. Este último evento desencadeou a decomposição e nucleação do SEI. Os autores concluíram que a formação de SEI depende principalmente da facilidade com que os ânions podem agarrar elétrons e se decompor em comparação com o solvente.
p Os cientistas usaram técnicas eletroquímicas e microscopia de força atômica para investigar o crescimento do cristal até a conclusão da camada. Eles descobriram que uma camada lisa se formou apenas em overpotenciais baixos. O solvente também influenciou o superpotencial. Os autores também observaram que os solventes com alta afinidade para a camada cristalina não produziram nenhum superpotencial.
p Eles concluíram que os projetos futuros de eletrodos de alto desempenho devem se concentrar mais na interação entre os íons negativos do sal de lítio e o solvente. Para permitir um inorgânico homogêneo, SEI cristalino a ser formado, os ânions devem competir com o solvente; eles devem se adsorver mais facilmente à superfície do eletrodo e realizar reações eletroquímicas. Além disso, os produtos de decomposição devem ser sólidos e insolúveis, mas ainda mostram uma certa afinidade com o solvente, disseram os autores.
