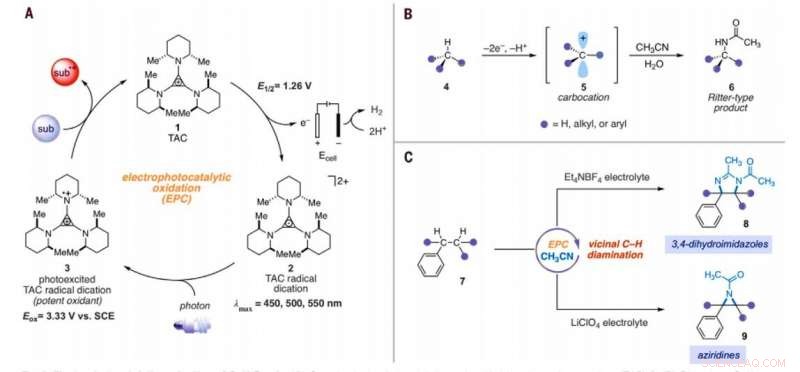
A aminação eletrofotocatalítica de ligações C – H. (A) Ciclo eletrofotocatalítico genérico com trisaminociclopropênio (TAC) 1. (B) Reação de aminação C – H do tipo Ritter. (C) Reações de diaminação C – H vicinais eletrofotocatalíticas relatadas neste trabalho. Sub, substrato; subox, substrato oxidado; Mim, metilo; Et, etilo; Ac, acetil; Eox, potencial de oxidação; lmax, comprimento de onda de absorção máxima. Crédito:Ciência, 10.1126 / science.abf2798
Química Inorgânica, a conversão de ligações inativadas de carbono-hidrogênio (C-H) em ligações carbono-nitrogênio (C-N) é uma transformação altamente valiosa. Os cientistas podem realizar tais reações em apenas um único local C-H, uma vez que a primeira derivatização pode diminuir a reatividade das ligações C-H circundantes. Em um novo relatório agora publicado em Ciência , Tao Shen e Tristan H. Lambert, do departamento de química e biologia química, Cornell University, Nova york, mostraram que arenos alquilados podem sofrer reações de diaminação C-H vicinais para formar 1, Derivados 2-diamina usando uma estratégia eletrofotocatalítica. Durante o processo sintético, eles usaram acetonitrila como solvente e fonte de nitrogênio. Eles catalisaram a reação usando um íon trisaminociclopropênio (TAC), que sofreu oxidação anódica para fornecer uma dicação radical estável (qualquer cátion), enquanto a reação catódica reduziu os prótons a hidrogênio molecular. Quando eles irradiaram a dicação do radical TAC com uma luz fluorescente compacta de luz branca, eles geraram um intermediário fotoexcitado fortemente oxidante. Com base no eletrólito usado, a equipe obteve 3, Produtos de 4-dihidroimidazol ou aziridina.
Um novo processo sintético
Reações químicas onipresentes que convertem ligações inertes de carbono-hidrogênio (C-H) em ligações valiosas de carbono-nitrogênio (C-N) podem acelerar muito a construção de moléculas complexas relevantes para o empreendimento biomédico. Os pesquisadores, portanto, derivaram uma série de reações de aminação C-H, mas apesar de seu poder e escopo, muitas campanhas sintéticas devem instalar várias ligações C-N. Um grande desafio para o desenvolvimento de tais reações químicas é que a heterofuncionalidade tende a desativar as ligações circundantes em direção aos modos mecanísticos típicos de ativação C – H. Até agora, apenas algumas tecnologias de reação realizaram funções multipotentes nas ligações C-H proximais. Shen et al. descreveu uma estratégia para química de oxidação potente combinando a energia da luz e eletricidade dentro de um único catalisador em um processo conhecido como eletrofotocatálise (EPC). Durante esta estratégia, a equipe usou a oxidação eletroquímica do íon trisaminociclopropênio (TAC) sob um potencial eletroquímico relativamente suave e irradiação de luz visível concomitante para excitar o intermediário catiônico radical resultante. O dication radical fotoexcitado foi um oxidante extremamente potente que demonstrou reações desafiadoras, incluindo funções oxidativas de benzeno e outros arenos pobres em elétrons ou a funcionalização C-H regiosseletiva de éteres.
Âmbito do substrato da diaminação C – H vicinal eletrofotocatalítica. Todos os rendimentos são de produtos isolados. Os produtos foram obtidos como misturas racêmicas; as representações em cunha e travessão indicam relações estereoquímicas relativas. (A) Diaminação de alquilbenzenos secundários. (B) Diaminação de alquilbenzenos primários. Detalhes experimentais são fornecidos nos materiais complementares. Um asterisco indica execução a 2,2 V; um símbolo de punhal (†) indica processamento com NaHCO3 (aq) e CH3OH; e um símbolo de punhal duplo (‡) indica nBu4NPF6 em vez de Et4NBF4. SM, materiais de partida. O Composto 36 foi desacilado após o processamento. Crédito:Ciência, 10.1126 / science.abf2798 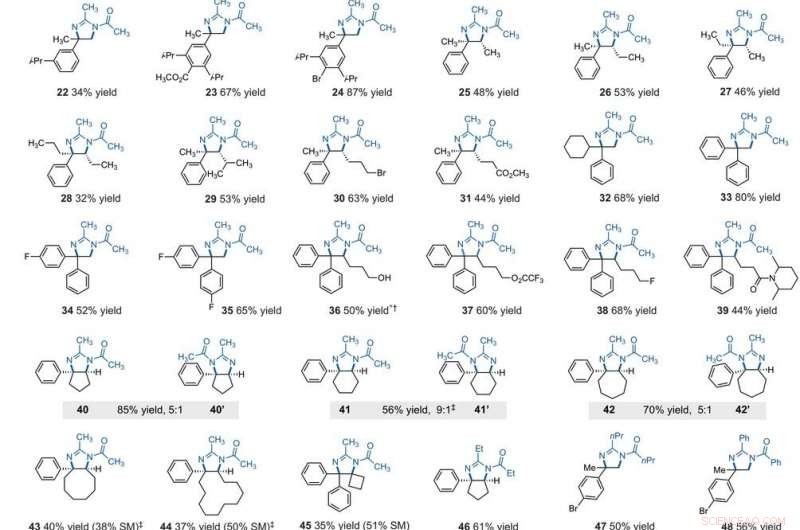
A equipe formulou a hipótese do poder oxidante do TAC para permitir também outros manifolds de ativação de ligação C-H. Sob as condições certas, a abordagem eletrofotocatalítica poderia gerar intermediários de carbo-cátions para facilitar a funcionalização do tipo Ritter de ligações C-H sem um oxidante químico externo. Tipicamente, durante as reações do tipo Ritter, geram um carbocátion com subsequente captura por um nitrila para formar intermediários de íon nitrílio seguidos por produtos de amida após a hidrólise. A equipe presumiu que a forte oxidação, ainda as condições seletivas oferecidas por TAC (trisaminociclopropênio) EPC (eletrofotocatálise) poderiam permitir uma sequência de múltiplas reações de funcionalização C-H do tipo Ritter, onde o grupo acetamida inicialmente formado facilitou uma segunda reação de aminação em uma posição adjacente. Se viável, o método pode facilitar a aminação regiosseletiva de duas ligações C-H simplesmente usando luz visível, um potencial eletroquímico moderado e um solvente comum como fonte de nitrogênio em vez de precursores de nitreno. Shen et al. reported the realization of the electrophotocatalytic deamination of C-H bonds to furnish dihydroimidazoles or aziridines, depending on the type of electrolyte used during the experiments.
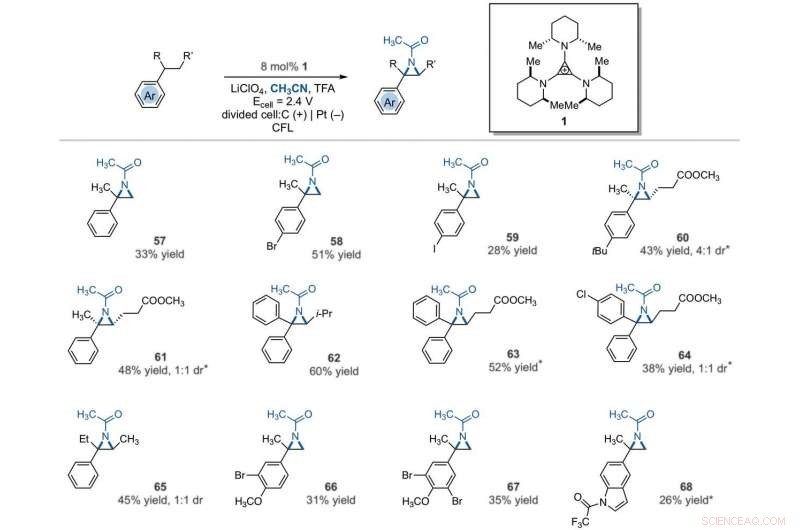
Electrophotocatalytic vicinal C–H aziridination. Detailed reaction conditions for each substrate are provided in the supplementary materials. Products were obtained as racemic mixtures; wedge and dash depictions indicate relative stereochemical relationships. An asterisk indicates run at 2.2 V. i-Pr, isopropyl. Crédito:Ciência, 10.1126/science.abf2798
The synthetic products
After extensively screening, the reaction conditions including the cell potential, electrolyte, acid additive and reaction time, Shen et al. identified conditions to assist the efficient conversion of a variety of benzylic hydrocarbons of the corresponding N-acyl-4, 5-dihydroimidazole adducts. In the reaction setup, the scientists used visible light irradiation with a white compact fluorescent light of a solution of the substrate containing TAC in a divided electrolytic cell under controlled potential. The team added the TAC catalyst and substrate within the anodic chamber where the C-H deamination chemistry occurred. The resulting redox by-product was effectively traceless. Based on similar conditions, a variety of benzylic hydrocarbons underwent vicinal C-H diamination to form diverse products. In all cases, the researchers noted how the function of methylene carbons occurred in preference to methyl carbons, even when in the presence of a sterically demanding group or electron-withdrawing group. Since the α-α-diaryl amines formed a valuable substructure in biomedically relevant compounds, the team also investigated the transformation on gem-diaryl substrates. They found that the 1, 1-diphenyl ethane reacted efficiently to furnish a secondary alkyl benzene compound with 80 percent yield. The compatibility of alcohol, ester, alkyl fluoride and amide substituents allowed the synthesis of more highly functionalized adducts.
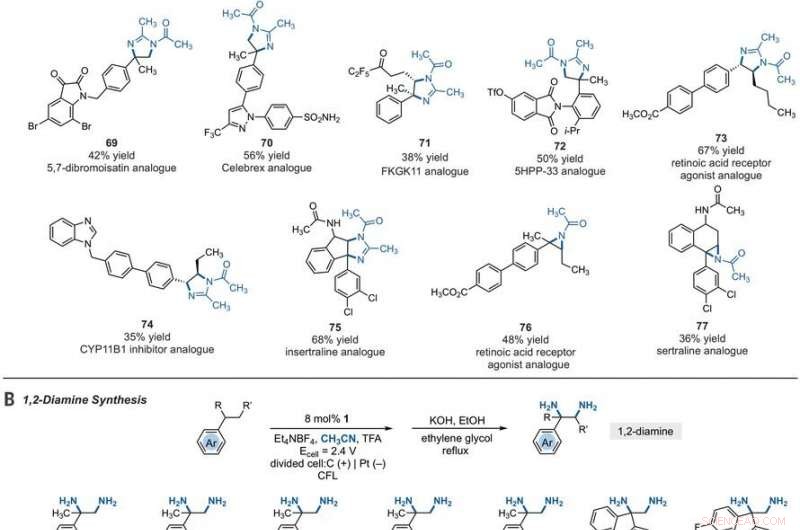
Synthetic applications of electrophotocatalytic vicinal C–H diamination. (A) Bioactive compound analogs prepared by means of electrophotocatalytic vicinal C–H diamination or aziridination. (B) 1, 2-Diamine synthesis. (C) Dihydroimidazole synthesis. (D) Bioactive compound synthesis. Detailed reaction conditions are provided in the supplementary materials. Products were obtained as racemic mixtures; wedge and dash depictions indicate relative stereochemical relationships. Products 80 and 81 were isolated as bis tosylate salts. Ph, fenil; Tf, trifluoromethanesulfonate. Crédito:Ciência, 10.1126/science.abf2798
Functionalizing ring systems
The team further studied the potential of this reaction to functionalize ring systems. The reaction of phenyl cyclopentane led to the bicyclic compound in 85 percent yield. The scientists produced six- and seven-membered ring products as regioisomeric mixtures, alongside eight- and 12-membered ring products as single isomers. They improved some of the yields for cyclic substrates by using tetrabutylammonium phosphate (TBAF 6 ) as the electrolyte. In addition to acetonitrile, the researchers used other nitriles to give rise to diaminated products derived from propionitrile, butyl nitrile or benzonitrile as the nitrogen source. The scientists also tested the diamination process using unbranched benzylic substrates. Como resultado, imine and halogenated derivatives gave rise to aziridines in low to modest yields with nearly equal yields of diaminated products.
Mechanistic rationale for electrophotocatalytic vicinal C–H diamination. Voltages were measured in a 5:1 mixture of CH3CN and TFA to mimic the reaction conditions and are relative to SCE. Crédito:Ciência, 10.1126/science.abf2798 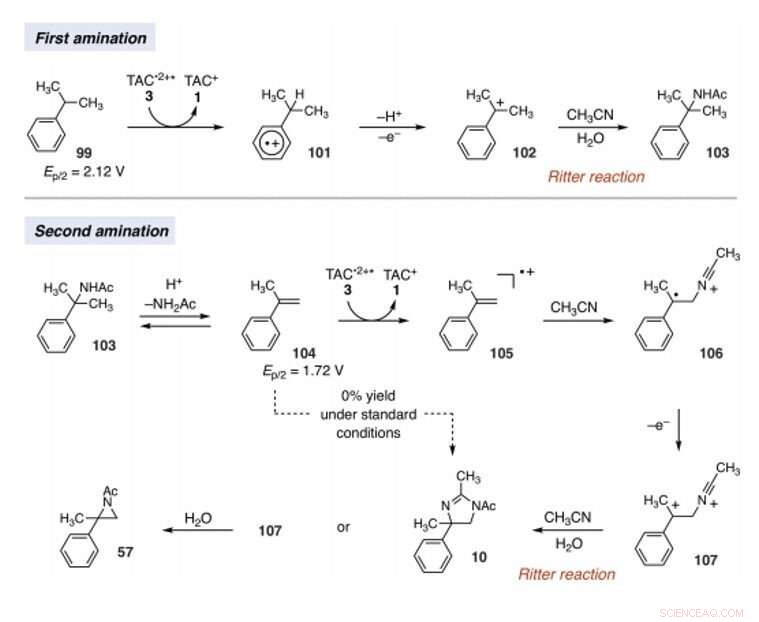
Since late-stage C-H functionalization processes offered powerful tools for the diversification of medicinal compound libraries, Shen et al. tested the difunctionalization chemistry on several molecules that are close analogs of known biologically active molecules. The team diaminated a dibromoisatin derivative to produce a bioactive molecule analogue in 42 percent yield. Por exemplo, Isatin derivatives have been investigated in the past due to their medicinal properties including antitumor and antiviral activities. The scientists also found that celecoxib analogs could produce 56 percent yield under standard conditions. They then converted an analog of thalidomide with antiproliferative activity into another bioactive analog with 50 percent yield. The team further found how a small modification to the electrophotocatalytic procedure could lead to the isolation of free 1, 2-diamines in good yields. Shen et al. believe the mechanisms to have originated with Ritter-type amination of the substrates benzylic C-H bond in a process that accords with known electrochemical Ritter-type reactions. Desta maneira, Tao Shen and Tristan H. Lambert noted the compatibility of deamination with a reasonable diversity of functionality for the practical applications of this reaction. The scientists used the power of combined light and electrical energy to conduct the reactions in the functionality of a single catalyst with advancing synthetic capabilities.
© 2021 Science X Network