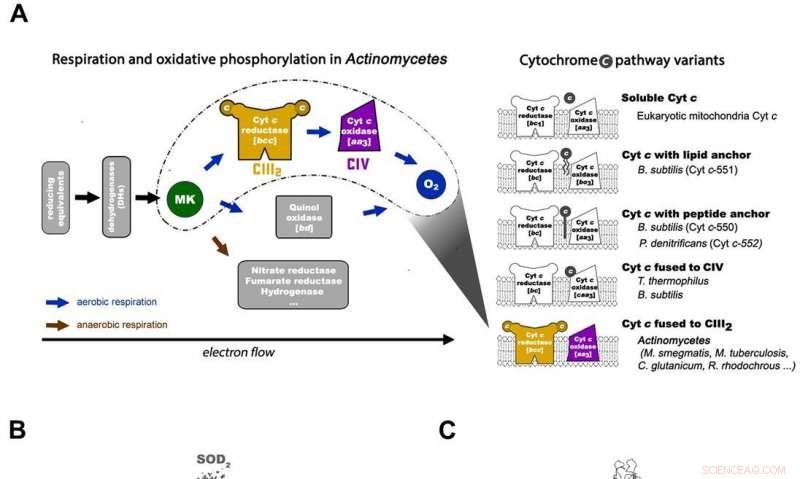
Respiração em Actinomicetos e arquitetura geral da máquina respiratória para micobactérias CIII2CIV2SOD2. A) A cadeia respiratória de transferência de elétrons em Actinomicetos (à esquerda) e as 5 principais variantes da via do citocromo c procariótico com os esquemas de organização em organismos representativos (à direita). A via do citocromo c de M. smegmas tem seu citocromo c fundido com o complexo III para formar um complexo III do tipo bcc que interage com o complexo IV do tipo aa3 para formar um supercomplexo CIII-CIV. MK =menaquinona / menaquinol. B) Toda a arquitetura do Supercomplex CIII-CIV respiratório tipo bcc-aa3 de M. smegmatis. O mapa crio-EM do supercomplexo mostra uma forma dimerizada 2 vezes linear de CIV1-CIII2-CIV1 com dimensões 200 x 70 x 120 Å. CIII é visto em laranja, CIV é magenta e os fatores de associação PRSAF1 em verde, LpqE em azul e SOD em cinza. C) Representação em desenho da vista lateral do supercomplex (em cima) e uma vista em corte transversal (em baixo). O MK é apresentado como esferas sólidas verdes brilhantes e os fosfolipídios como bastões amarelos. Na vista em corte transversal na parte inferior, os limites de CIII, CIV e fator de associação PRSAF1 são representados em linhas tracejadas em cores (laranja para CIII, magenta para CIV e verde para PRSAF1). Crédito: Ciência , doi:10.1126 / science.aat8923.
Em um estudo recente conduzido por Hongri Gong e colegas, um supercomplexo respiratório foi isolado da bactéria Mycobacterium smegmatis, e sua estrutura foi visualizada com uma resolução de 3,5 Å usando microscopia crioeletrônica (crio-EM). A bactéria é um parente próximo do M. tuberculosis e um modelo popular usado para estudar muitas outras espécies bacterianas. A estrutura detalhada revelou como os elétrons foram transferidos na célula em um processo até então invisível.
Tipicamente, energia química para sintetizar trifosfato de adenosina (ATP) e reações celulares de energia é extraída durante a respiração celular por meio do acoplamento da oxidação de uma fonte de energia (açúcares, ácidos graxos e aminoácidos) e a redução de um aceptor de elétrons (oxigênio, enxofre, nitrato e sulfato). Na respiração celular aeróbia, a energia é extraída de doadores de elétrons para o aceitador terminal, oxigênio, através da cadeia de transporte de elétrons (ETC) para criar um gradiente de prótons transmembrana conhecido como força motriz de prótons (PMF) que conduz a síntese de ATP. Os novos resultados agora publicados em Ciência revelam uma ligação direta para a transferência de elétrons entre enzimas para representar um novo modo de catálise da cadeia respiratória.
Quinonas e citocromos são dois tipos de portadores de elétrons em ETCs usados para transportar elétrons de e para grandes estruturas macromoleculares embutidas na membrana. Quatro oxidorredutases de membrana estão envolvidas na cadeia respiratória mitocondrial para a transferência de elétrons. Estes incluem o complexo I (NADH:ubiquinona oxidoredutase, CI), complexo II (succinato:ubiquinona oxidoredutase, CII), complexo III (bc 1 -tipo ubiquinol:citocromo c oxidoredutase, ac 1 -tipo CIII) e complexo IV (aa 3 -tipo citocromo c oxidase, aa 3 -tipo CIV). Por função, O CIII pode oxidar o ubiquinol a ubiquinona e passar os elétrons ao citocromo c solúvel. Os elétrons são então transportados para o CIV, onde o oxigênio é reduzido a água. O PMF transmembrana é gerado pelo bombeamento de prótons em CI, CIII e CIV.
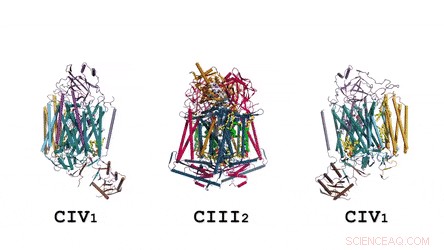
A arquitetura do supercomplexo em sua totalidade:A representação em quadrinhos mostra a menaquinona / menaquinol (MK) em esferas sólidas de cor verde brilhante e os fosfolipídios como bastões amarelos. Crédito: Ciência , doi:10.1126 / science.aat8923
Na cadeia respiratória procariótica, a situação é mais complicada. Um caminho completo de fluxo de elétrons ainda não foi determinado no tipo de célula devido à sua complexidade. Portanto, é necessário compreender a estrutura completa de um "supercomplexo" envolvido durante a transferência bacteriana de elétrons para auxiliar o objetivo. No estudo, os pesquisadores extraíram e purificaram o complexo de M. smegmatis para visualizar a arquitetura usando microscopia crioeletrônica (crio-EM) com uma resolução de 3,5 Å. A estrutura forneceu insights cruciais sobre o mecanismo de transferência direta de elétrons dentro de um supercomplexo respiratório. As dimensões do supercomplex estavam na faixa de 200 x 70 x 120 Å, em uma arquitetura linear simetrizada completamente diferente dos supercomplexos respiratórios relatados anteriormente. Por composição, o CIV dimérico linear 1 -CIII 2 -CIV 1 foi organizado de forma que CIVs individuais flanqueavam o dímero CIII central em ambos os lados. A informação revelou uma ligação direta entre as enzimas durante a transferência de elétrons, representando um novo modo de catálise da cadeia respiratória. As descobertas estruturais detalhadas têm potencial para auxiliar nos esforços de descoberta de drogas antimicobacterianas.
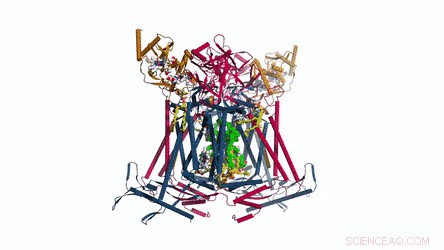
A composição e estrutura do dímero CIII. A menaquinona / menaquinol apresenta-se como esferas sólidas verdes brilhantes e os fosfolipídios são bastões amarelos. Crédito: Ciência , doi:10.1126 / science.aat8923
Durante os experimentos de cultura de células bacterianas, os autores usaram uma cepa mutante de M. smegmatis resistente ao peróxido de hidrogênio semelhante ao M. tuberculosis. As células foram cultivadas e a membrana isolada conforme descrito anteriormente. Após a cultura de células, colheita e lise celular, pellets de membrana celular foram colhidos para extrair supercomplexos respiratórios. Os supercomplexos foram caracterizados por espectroscopia óptica, espectroscopia de massa e 3, Coloração com 3'-diaminobenzidina (DAB). Para identificar grupos heme, as frações selecionadas foram analisadas registrando os espectros antes e depois da redução com ditionato, conforme descrito anteriormente. As amostras purificadas foram analisadas usando espectroscopia de massa nativa para investigar a arquitetura e os componentes estruturais individuais foram analisados usando protocolos previamente estabelecidos.
Durante a análise crio-EM, os pesquisadores usaram acetato de uranila (1 por cento w / v) para coloração negativa, usando 5 µl da amostra supercomplex a uma concentração de 0,05 mg / ml, As imagens foram obtidas em um microscópio FEI Tecnai Spirit operando a 120 kV para a construção inicial do modelo. As imagens adquiridas foram processadas usando uma reconstrução de baixa resolução do supercomplex de 53 micrografias da amostra com coloração negativa. Para a reconstrução completa do supercomplex, os autores selecionaram manualmente 7, 600 micrografias de 8, 200 micrografias originais durante o processamento de imagem crio-EM. Todas as figuras no estudo foram criadas usando quimera PyMOL ou UCSF.

A composição e estrutura do CIV. Representação dos desenhos animados do complexo IV. Os fosfolipídios são mostrados como bastões amarelos. Crédito: Ciência , doi:10.1126 / science.aat8923
Os autores revelaram a estrutura crio-EM de um supercomplexo respiratório CIII-CIV da bactéria M. smegmatis. A via de transferência de elétrons intra-complexa variou de oxidação de quinol em CIII a redução de oxigênio em CIV. Os resultados mostraram um novo mecanismo para a transferência de elétrons bifurcada para garantir a conclusão do ciclo Q (o movimento líquido de prótons através de uma bicamada lipídica) para a transdução de energia. A associação de uma superóxido dismutase na arquitetura do sistema pode proteger contra danos oxidativos por espécies reativas de oxigênio (ROS). A arquitetura dos sítios de ligação da quinona também forneceu uma estrutura para estudos futuros na descoberta de drogas antimicrobianas baseadas na estrutura.
© 2018 Science X Network