Estruturas de alta resolução da proteína arqueodopsina-3 lançam uma nova luz sobre a dessensibilização do receptor
 p Cristais de AR3 observados sob luz polarizada (esquerda). Crédito:os direitos autorais das imagens pertencem aos autores, de acordo com os termos e condições da Nature Communications
p Cristais de AR3 observados sob luz polarizada (esquerda). Crédito:os direitos autorais das imagens pertencem aos autores, de acordo com os termos e condições da Nature Communications
p Pela primeira vez, uma equipe internacional de pesquisadores visualizou a proteína sensível à luz archaerodopsina-3 (AR3) em resolução sem precedentes usando as linhas de luz I24 e B23 na Diamond Light Source. O fotorreceptor é expresso por Halorubrum sodomense, um organismo que cresce no Mar Morto, mas é mais conhecido por suas aplicações em experimentos optogenéticos, em que é usado para silenciar neurônios individuais e para detectar mudanças na voltagem da membrana celular. Essas novas estruturas abrem caminho para o desenvolvimento de novas ferramentas e metodologias nos campos da neurociência, biologia celular e além. p Em seu jornal, publicado hoje em
Nature Communications , a equipe relata a estrutura inédita do estado fundamental do AR3. Neste estado, a proteína está configurada para transportar um H
+
íon através da membrana celular para cada fóton absorvido. A equipe também conseguiu cristalizar o fotorreceptor em uma segunda conformação, um estado dessensibilizado que é adotado pelo AR3 na ausência prolongada de luz.
p O autor correspondente, Prof. Anthony Watts, da Universidade de Oxford, diz; "A excelente resolução que alcançamos para essas estruturas AR3, 1,07 Å para o estado fundamental, está entre as mais altas para uma proteína de membrana de tipo selvagem depositada até o momento no Protein Data Bank. Essa qualidade nos permite visualizar diretamente a distribuição complexa das moléculas de água dentro do receptor e descrever o significado funcional das intrincadas redes de ligações de hidrogênio que elas formam, algo que é importante em muitas biomoléculas - não apenas nos fotorreceptores. Essas redes em AR3 envolvem interações com o grupo retinal e cadeias laterais de aminoácidos e, nesse papel, mostramos como eles são alterados entre os estados básico e dessensibilizado da proteína. "
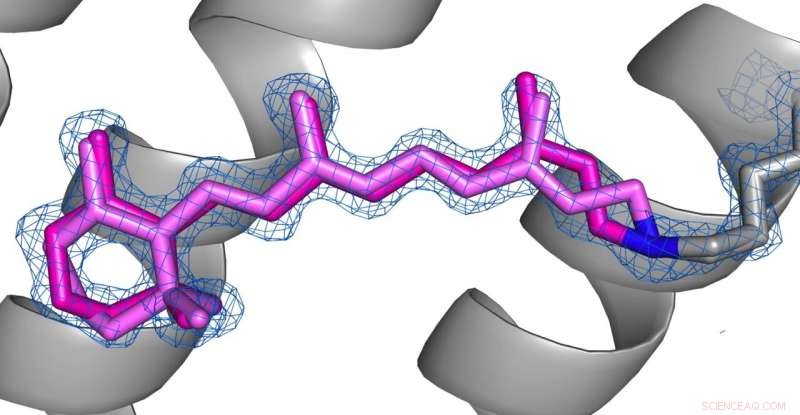 p Comparação das conformações da retina (rosa) no estado dessensibilizado (foto 1) e estado fundamental (foto 2) de AR3. Crédito:os direitos autorais das imagens pertencem aos autores, de acordo com os termos e condições da Nature Communications
p Comparação das conformações da retina (rosa) no estado dessensibilizado (foto 1) e estado fundamental (foto 2) de AR3. Crédito:os direitos autorais das imagens pertencem aos autores, de acordo com os termos e condições da Nature Communications
p Explicando o significado da proteína AR3, comentários do co-primeiro autor Dr. Juan Francisco Bada Juarez; "Os empolgantes desenvolvimentos em optogenética na última década levaram a um intenso interesse em AR3 de cientistas de todo o mundo. Mutantes da proteína são usados rotineiramente em experimentos neurocientíficos para silenciar seletivamente células nervosas individuais e também para detectar mudanças na voltagem transmembrana. , esses mutantes foram projetados sem o conhecimento da estrutura da própria proteína. Nossos dados fornecem aos biólogos estruturais e engenheiros de proteínas os 'planos' para AR3 e, como resultado, podemos esperar uma aceleração significativa no desenvolvimento de novas ferramentas optogenéticas. "
p A co-autora doutora Isabel Moraes do National Physical Laboratory (NPL) acrescenta:
p "Os dados de difração de altíssima resolução nos permitiram observar em grande detalhe a liberdade de movimento de vários aminoácidos importantes e moléculas individuais de água dentro do fotorreceptor. Resolver as estruturas AR3 foi extremamente desafiador, por causa da complexidade das características que podemos distinguir na resolução atômica. Muitas cadeias laterais de aminoácidos dentro da proteína foram resolvidas em mais de uma posição ou orientação, indicando sua importância para a função da proteína. O conhecimento da dinâmica desses grupos foi fundamental para entender como ocorrem os processos de sensibilização e dessensibilização. ”
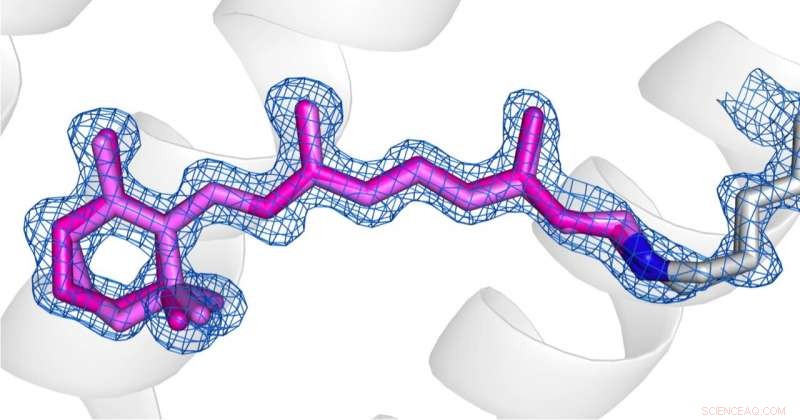 p Comparação das conformações da retina (rosa) no estado dessensibilizado (foto 1) e estado fundamental (foto 2) de AR3. Crédito:os direitos autorais das imagens pertencem aos autores, de acordo com os termos e condições da Nature Communications
p Comparação das conformações da retina (rosa) no estado dessensibilizado (foto 1) e estado fundamental (foto 2) de AR3. Crédito:os direitos autorais das imagens pertencem aos autores, de acordo com os termos e condições da Nature Communications
p Essencial para compreender o funcionamento da proteína, foram as estruturas de cristal de alta resolução resolvidas pela equipe. A obtenção de tais dados de difração de alta qualidade não teria sido possível sem a linha de luz de microfoco de última geração na Diamond Light Source, o síncrotron nacional do Reino Unido, perto de Didcot em Oxfordshire. A equipe trabalhou em estreita colaboração com vários especialistas da Diamond.
p "Os microcristais cultivados pelas equipes de Oxford e NPL eram perfeitamente adequados às capacidades da linha de luz I24. Usando o software desenvolvido pelo grupo de desenvolvimento de software DIALS da Diamond, fomos capazes de combinar imagens de difração de múltiplos cristais para obter conjuntos de dados completos. A combinação de entrega precisa de raios X de microfoco e análise avançada de dados nos permitiu levar a resolução das estruturas resultantes ao limite. ”, Diz o cientista Diamond Senior Beamline Dr. Danny Axford.
p Em conclusão, o Prof. Watts acrescenta:"Este foi um estudo fascinante. Foi um prazer trabalhar com tantos colegas especialistas no Reino Unido e em todo o mundo. Não só agora temos um conhecimento altamente detalhado das estruturas de dois importantes estados funcionais do AR3, mas os insights obtidos aprofundam nossa compreensão de como os processos de sensibilização e dessensibilização ocorrem em muitas outras proteínas receptoras. "


