Sistema de degradação da celulose bacteriana pode impulsionar a produção de biocombustíveis
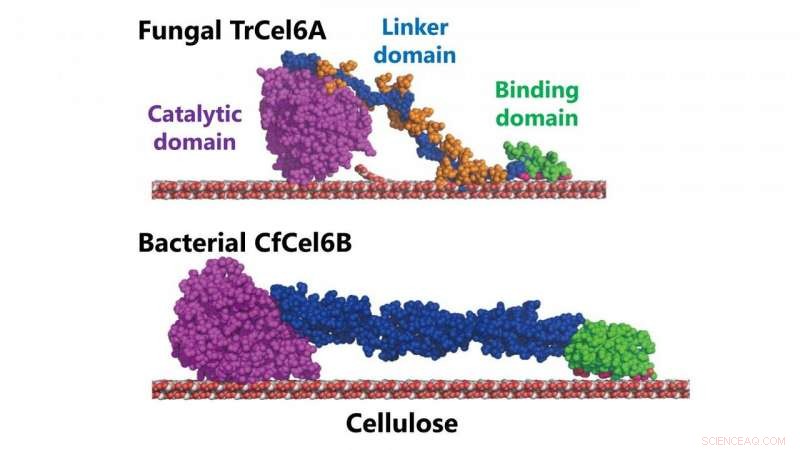 p Modelos estruturais de celobiohidrolases fúngicas e bacterianas (TrCel6A, CfCel6B) Crédito:NINS / IMS
p Modelos estruturais de celobiohidrolases fúngicas e bacterianas (TrCel6A, CfCel6B) Crédito:NINS / IMS
p Esforços para encontrar maneiras de quebrar a celulose - o material resistente que compõe as paredes das células vegetais - de maneira mais rápida e produtiva tem sido uma meta dos pesquisadores industriais. p Quando as plantas são processadas em biocombustíveis ou outras aplicações de biomassa, a celulose deve ser degradada em moléculas de açúcar mais simples primeiro, e esta etapa pode representar até um quarto dos custos operacionais e de capital da produção de biocombustíveis. Se esse processo puder ser mais rápido e produtivo, não vai apenas economizar dinheiro da indústria, mas tais eficiências também podem reduzir o impacto ambiental da produção.
p As moléculas de celulose se ligam fortemente umas às outras, tornando a celulose muito difícil de quebrar. Alguns fungos são capazes de decompô-lo, Contudo, e seus sistemas de degradação de celulose são bem conhecidos.
p Os fungos produzem muitos tipos de
celulases —Enzimas que aceleram a reação química que degrada a celulose. E tais fungos têm sido amplamente utilizados na indústria por esse motivo. Por exemplo, o fungo
Trichoderma reesei —Descoberto durante a Segunda Guerra Mundial no Pacífico como resultado de sua destruição em barracas e roupas — é usado na produção de jeans lavados à pedra.
Celobiohidrolase , um tipo de celulase que o fungo produz, decompõe a celulose em celobiose, um açúcar simples mais facilmente utilizável pelos organismos. Isso degrada levemente o material denim em alguns lugares, o que, por sua vez, o amolece - fazendo com que pareça ter sido lavado com pedras - e o torna mais confortável de usar.
p Mas existe outro tipo de sistema de degradação da celulose usado por algumas bactérias, e que é semelhante em muitos aspectos ao usado por este fungo. Mas este sistema não foi muito bem compreendido até agora. Em um jornal no
Journal of Biological Chemistry em 18 de agosto, pesquisadores do Instituto de Ciência Molecular do Japão, Institutos Nacionais de Ciências Naturais (IMS, NINS) finalmente descreveu este sistema em detalhes no nível de uma única molécula.
p O tipo de celobiohidrolase produzida pela bactéria
Cellulomonas fimi tem um domínio catalítico semelhante à celobiohidrolase produzida por
T. reesei . O domínio catalítico de uma enzima é sua região que interage com uma molécula que ela deseja alterar ou quebrar (para causar a reação enzimática). Tanto o fungo quanto o sistema de degradação da celulose da bactéria também exibem atividade hidrolítica semelhante (a maneira como usam a água para quebrar as ligações químicas da celulose).
p Mas os dois sistemas têm diferentes módulos de ligação de carboidratos (a série de proteínas na enzima que se ligam aos carboidratos na celulose) e os chamados "ligantes", em essência, a parte da enzima que liga o domínio catalítico aos módulos de ligação de carboidratos.
p Em pesquisas anteriores, os cientistas do NINS já haviam estabelecido que a estrutura da região de ligação da celobiohidrolase fúngica desempenhava um papel crucial na rapidez com que a enzima se ligava à celulose (e, portanto, na rapidez com que o sistema degrada a celulose).
p "Portanto, as próximas perguntas óbvias eram:embora essas outras partes da celobiohidrolase da bactéria sejam diferentes das do fungo, eles fazem algo semelhante? ", disseram Akihiko Nakamura e Ryota Iino, os pesquisadores da equipe. "Eles também aceleram a degradação da celulose?"
p Eles descobriram que sim. Os cientistas usaram imagens de fluorescência de molécula única - um método avançado de microscopia que fornece imagens de células vivas com resolução de apenas dezenas de nanômetros - para observar a ligação da celobiohidrolase da bactéria e a dissociação das moléculas de celulose.
p Isso permitiu que eles esclarecessem as funções das diferentes partes do sistema de degradação da celulose. Eles descobriram que os módulos de ligação de carboidratos eram realmente importantes para a ligação inicial, mas o papel desempenhado pela região do linker era bastante menor.
p Contudo, eles descobriram que o domínio catalítico não era tão semelhante, afinal. Sua estrutura apresentava alças mais longas na entrada e na saída de um "túnel" no coração do sistema em comparação com a do fungo. E essa diferença na estrutura do túnel resulta em maior processabilidade - a capacidade de uma enzima de desencadear várias reações consecutivas.
p Os próximos passos serão desenvolver essas enzimas de degradação da celulose bacteriana para quebrar a celulose mais rapidamente.
