Crédito:Universidade da Califórnia, Los Angeles
The Tang, Garg, e os grupos de pesquisa Houk descobriram os catalisadores de proteínas naturais (enzimas) que catalisam a reação do amieiro.
Todos os grupos fazem parte do Departamento de Química e Bioquímica da UCLA. O Professor Yi Tang é o Professor Chanceler do Departamento de Engenharia Química e Biomolecular da UCLA e também tem um cargo conjunto no Departamento de Bioengenharia. O professor Ken Houk detém a cadeira de pesquisa distinta de Saul Winstein em química orgânica e o professor Neil Garg detém a cadeira Kenneth N. Trueblood em química e bioquímica e atua como presidente do departamento.
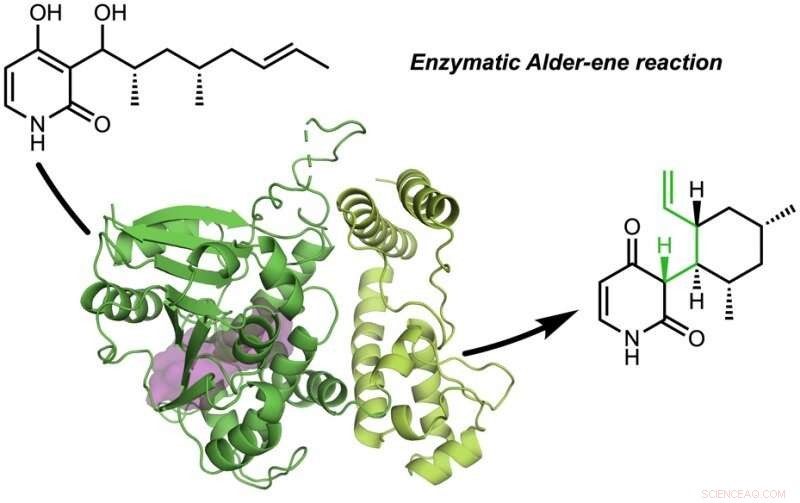
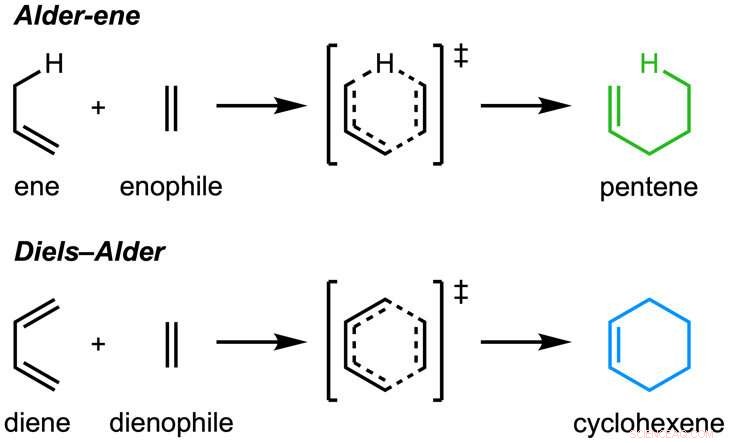
O papel, "Uma reação enzimática de amieiro" foi publicada em Natureza . A reação de Alder-ene foi descoberta em 1943, mas até agora tem sido usado apenas para síntese química em laboratório. A reação de Alder-eno é um exemplo de uma reação pericíclica e um análogo da amplamente conhecida reação de Diels-Alder. Anteriormente, Tang e Houk identificaram uma nova classe de enzimas - as periciclases - por sua capacidade de acelerar as reações pericíclicas no metabolismo primário e secundário.
Em colaboração com Jiahai Zhou, do Instituto de Química Orgânica de Xangai, os grupos Tang-Garg-Houk relataram as estruturas e mecanismos de dois grupos de enzimas que catalisam uma desidratação estereosseletiva e reação pericíclica concomitante, mostrado abaixo, onde os pequenos símbolos como PdxI indicam enzimas naturais (catalisadores de proteínas) descobertas pelo grupo Tang. Um grupo de enzimas catalisa uma reação de amieiro, e o segundo catalisa reações hetero-Diels-Alder.
Crédito:Universidade da Califórnia, Los Angeles

Crédito:Universidade da Califórnia, Los Angeles
O artigo descreve a síntese divergente de piridoxatina e asperpiridona A. Partindo do substrato de álcool, as enzimas facilitam a desidratação para formar um intermediário de meteto de quinona reativo a partir do qual os esqueletos de piridoxatina e asperpiridona A podem se formar por reação de Alder-eno ou Diels-Alder. Masao Ohashi do grupo Tang, e Cooper Jamieson nos grupos Houk e Tang trabalharam juntos para identificar os fatores nas enzimas que controlam a reação que ocorre. As previsões computacionais guiaram modificações experimentais que alteraram as enzimas de modo a catalisar a outra reação. Este tipo de engenharia de proteínas promete influenciar a síntese laboratorial de produtos naturais relacionados no futuro.
Crédito:Universidade da Califórnia, Los Angeles
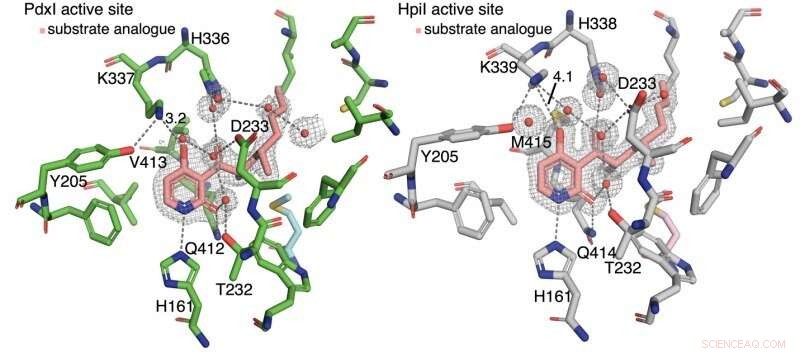
Os autores descobriram que a ligação de hidrogênio à piridona C4 controla o tipo de reação. Nas enzimas PdxI, AdxI, e MdxI, um resíduo de lisina (K337) ligações de hidrogênio a C4. Isso diminui a nucleofilicidade do oxigênio e desfavorece a reação hetero-Diels-Alder. PdxI, AdxI, e o MdxI usa essa estratégia para formar seletivamente o esqueleto da piridoxatina. Enzimas EpiI, UpiI, e HpiI bloqueia esta ligação de hidrogênio de ocorrer com um resíduo de metionina flexível (M415) e, assim, facilita a formação do esqueleto de asperpiridona A. Esta diferença geométrica sutil nos sítios ativos faz uma mudança eletrônica bastante grande no substrato e controla a reação pericíclica enzimática.