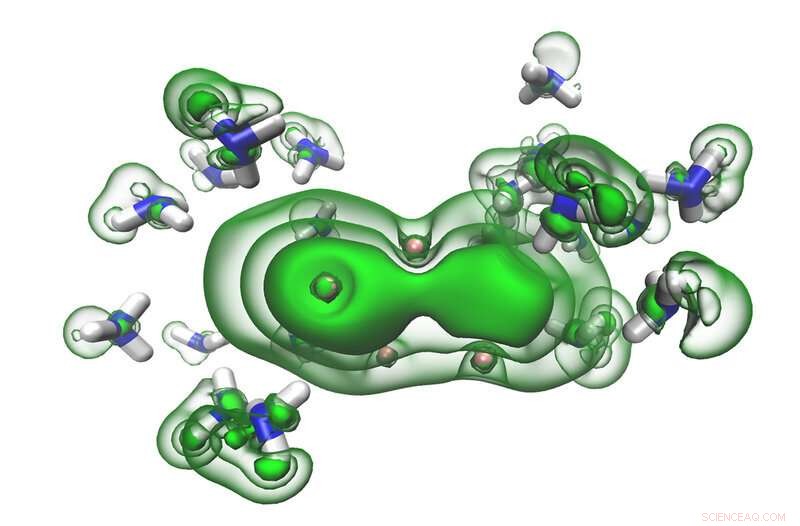
Os elétrons dissolvidos (verdes) nas lacunas entre as moléculas de amônia (azuis e brancas) começam a se aglutinar em um par à medida que uma solução se move para se tornar metálica. Crédito:Ryan McMullen
Ryan McMullen nunca tinha ouvido falar do USC Dornsife College of Letters, Artes e Ciências quando ele começou a procurar um programa de pós-graduação em química. Mas por recomendação de um de seus professores, ele enviou um e-mail para o professor de química da faculdade Stephen Bradforth propondo um experimento para descobrir o que torna um metal realmente um metal.
A proposta não se transformaria apenas em seu doutorado. tese, mas um grande avanço científico.
A proposta de McMullen não foi fácil de vender. O experimento seria caro e possivelmente perigoso.
Os acadêmicos que McMullen contatou em outras universidades de pesquisa dos EUA disseram a ele que tinham financiamento para suas próprias pesquisas, mas não para ele. Mas Bradforth teve uma resposta diferente.
"Ele disse, 'Eu não tenho financiamento para a sua ideia, mas se você vier aqui, podemos escrever uma proposta de financiamento juntos, '"disse McMullen, que na época estava concluindo seus estudos de graduação na Universidade de Bristol, no Reino Unido.
Bradforth não só ajudou McMullen a garantir financiamento, priorizando-o para o apoio da National Science Foundation sobre a continuação de outros projetos, mas também montou uma equipe internacional de cientistas e organizou seu ano sabático para supervisionar e participar dos experimentos principais. Ele também se tornou o Ph.D. de McMullen. conselheiro.
Bradforth reconfigurou seu laboratório para proteger seus cientistas. O experimento exigia amônia líquida, que pode ser levemente tóxico, e metal alcalino, que pode explodir se tocar na água.
"Meu laboratório parece diferente por causa disso, "observou Bradforth, que também é reitor divisionário de ciências naturais e matemática.
O esforço valeu a pena o resultado. O experimento revelou descobertas que são "o tipo de coisa que aparece nos livros didáticos, ou pelo menos muda a forma como os livros são escritos, "Bradforth disse, observando a importância potencialmente histórica da obra. Também ganharia a cobiçada distinção de ser a capa de 5 de junho da revista Science.
Indo totalmente metal
O projeto abordou uma questão fundamental:quais propriedades são inerentes a um metal e quais são incidentais?
A intuição sugere que os metais são densos, e embora isso seja verdade para alguns (pense em ouro ou chumbo), não se sustenta para os outros. Por exemplo, o lítio - comumente usado em baterias - flutua na água. Alguns metais são duros, como titânio, ainda outros cedem facilmente à pressão, incluindo índio e alumínio. Que tal a temperatura de derretimento? Platina derrete em mais de 1, 700 graus Celsius (3, 200 F), mas o mercúrio é um líquido bem abaixo de zero.
Muitas outras definições de 'capa de metal' sofrem contradições semelhantes, mas apenas metais são capazes de conduzir eletricidade. Condução, ao contrário da densidade ou dureza, é uma propriedade inerente de todos os metais.
Buscando entender melhor as propriedades intrínsecas dos metais, Bradforth, McMullen e seus colegas usaram um truque observado pela primeira vez pelo químico Sir Humphry Davy em 1809. Em essência, eles fizeram um metal do zero.
Os cientistas resfriaram a amônia - normalmente um gás em temperatura ambiente - a menos 33 C para liquefazê-la e, em seguida, adicionaram, em experimentos separados, o lítio de metais alcalinos, sódio e potássio.
Nessas soluções, elétrons do metal alcalino inicialmente ficam presos nas lacunas entre as moléculas de amônia. Isso cria o que os cientistas chamam de 'elétrons solvatados, 'que são altamente reativos, mas estabilizados na amônia. Essas soluções têm uma cor azul característica. Mas, dado o número suficiente de elétrons solvatados, todo o líquido fica bronze e, em essência, torna-se um metal enquanto permanece líquido.
Os elétrons solvatados provaram ser importantes para os químicos orgânicos. Por meio de uma reação chamada de "redução de vidoeiro, "nomeado após o químico Arthur Birch, eles foram essenciais para a síntese de muitos compostos importantes e levaram à fabricação de anticoncepcionais orais na década de 1950.
Irradiando elétrons
Em seguida, os cientistas mediram a quantidade de energia necessária para retirar os elétrons solvatados da amônia metálica, usando um feixe de raios-X extremamente brilhante e focado com base em Berlim.
Em um experimento inédito, eles forçaram diferentes concentrações de amônia metálica por meio de um microjet, que criou uma corrente com a largura de um fio de cabelo humano que então passou por um feixe de raios-X muito fino.
Os resultados mostraram que, em baixas concentrações, elétrons solvatados foram mais facilmente desalojados da solução pela interação com os raios-X, dando um padrão de energia simples. Em concentrações mais altas, no entanto, o padrão de energia de repente desenvolveu uma borda de banda afiada, indicando que a solução estava se comportando como um metal.
Embora as implicações práticas do resultado necessitem de mais pesquisas, o experimento abre uma nova janela para os químicos sintetizarem compostos orgânicos importantes. Assim como a redução do Birch levou a anticoncepcionais orais, tão, também, poderia este experimento levar a novos compostos para uso em um número incontável de maneiras.
Jersey Boy
McMullen, um nativo de Jersey (o original europeu, não o estado vizinho a Nova York), planeja retornar ao seu laboratório na USC Dornsife dentro de algumas semanas. Mas ele não deixou a pandemia COVID-19 atrasá-lo. Sempre curioso sobre como a eletrônica funciona, ele está realizando experimentos - com segurança, claro, de seu apartamento em Long Beach, Califórnia, usando componentes que ele comprou no e-Bay.
Depois de completar seu Ph.D., McMullen, o primeiro de sua família a frequentar a faculdade, planos para buscar uma bolsa de pós-doutorado, embora ele não tenha certeza de onde ou no que se concentrará. Ele sabe, Contudo, que ele quer permanecer na academia. Onde quer que ele aterrisse, é quase certo que o mundo da química ouvirá falar dele novamente.
"Eu gosto de fazer coisas exóticas."