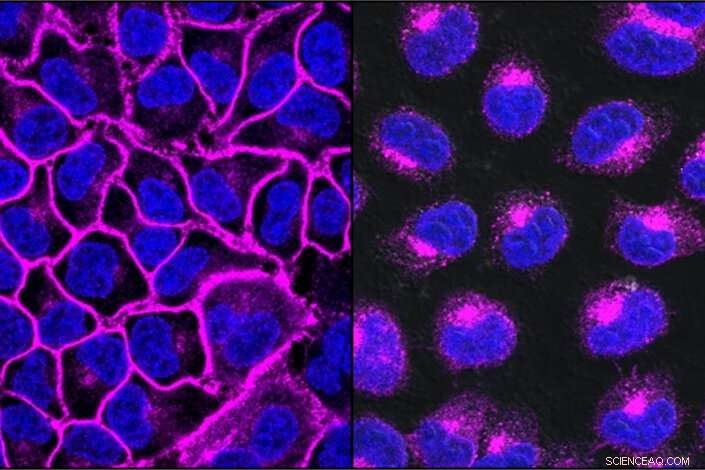
EGFR, uma proteína importante para ajudar o câncer a crescer, mostrado aqui em roxo, decora a superfície da célula (esquerda). Após o tratamento com um LYTAC direcionado a EGFR, toda a proteína EGFR é transportada para os lisossomas, os compartimentos de degradação dentro da célula (direita). Crédito:Steven Banik
Quando os cientistas encontram uma proteína potencialmente perigosa em uma célula, eles podem imaginar encolhendo-se para se tornarem pequenos cirurgiões, cortar apenas a molécula problemática e deixar as partes saudáveis da célula intactas. Embora mãos hábeis e instrumentos afiados nunca sejam capazes de extirpar uma única proteína da superfície de uma célula, uma nova ferramenta molecular pode tornar a cirurgia celular mais fácil, de acordo com um estudo publicado em Natureza em 29 de julho.
Os químicos de Stanford desenvolveram uma nova classe de moléculas que transportam proteínas indesejadas da superfície ou ambiente circundante de uma célula para o lisossoma, o compartimento celular dedicado à degradação de proteínas. Essas moléculas, chamadas quimeras de direcionamento de lisossoma, ou LYTACs, funcionam marcando seletivamente uma proteína com um rótulo que sela seu destino para o descarte de lixo celular. Esta degradação seletiva pode ajudar os pesquisadores a estudar e tratar doenças como câncer e Alzheimer, cujas causas estão ligadas às proteínas de superfície.
"É como um bisturi molecular, "disse o autor principal Steven Banik, um pós-doutorado no laboratório de Carolyn Bertozzi, a Anne T. e Robert M. Bass Professores na Escola de Humanidades e Ciências. "Esta ferramenta permite que você acelere a degradação natural de uma proteína individual entre todas as diferentes proteínas que estão dentro ou fora de uma célula."
As proteínas são vitais para muitos processos biológicos, como metabolismo e comunicação intercelular, mas alguns também podem ajudar a disseminar doenças como o câncer e evitar a regulação imunológica. Os métodos tradicionais para impedir esses malfeitores envolvem o uso de drogas que bloqueiam o sítio ativo da proteína, onde outros componentes celulares podem acoplar enquanto a proteína vai trabalhar neles, geralmente movendo os átomos. Mas essa estratégia de bloqueio é imperfeita; às vezes, a bolsa de ligação é muito rasa e o inibidor salta muito rapidamente. Outros tempos, a atividade de uma proteína deriva de suas propriedades físicas, como sua rigidez, e não de qualquer site ativo, portanto, bloquear uma pequena porção da proteína inteira é insuficiente. Nesses casos, drenar a proteína da célula é a única opção.
A degradação de proteínas como estratégia terapêutica tem sido especialmente popular desde o desenvolvimento de PROTACs, ou quimeras de direcionamento de proteólise, 20 anos atras. PROTACs, que procuram e rotulam proteínas intracelulares para degradação, viram o sucesso em laboratórios de pesquisa e nos primeiros estudos clínicos, mas dependem de uma via de degradação que é inacessível a cerca de 40% de todas as proteínas que ficam no topo ou fora da membrana celular. Bertozzi e Banik não aceitaram que certas proteínas - e doenças - estariam fora de alcance.
"Meu laboratório sempre se interessou pelo que está acontecendo na superfície da célula, que contém todas essas proteínas importantes para a modulação imunológica, "disse Bertozzi, que também é o co-diretor da família Baker de Stanford ChEM-H. "Identificamos muitas proteínas de superfície e secretadas que acreditamos estarem desempenhando papéis patogênicos no câncer, e os LYTACs podem nos ajudar a entendê-los melhor e explorá-los como alvos de drogas. "
A chave para fazer a ferramenta funcionar é seu design bifuncional. Um lado desta molécula pode ser customizado para se ligar a qualquer proteína de interesse. Por outro lado, está uma curta sequência de aminoácidos, ou peptídeo, cravejado com um açúcar chamado manose-6-fosfato.
Esse açúcar serve como rótulo contábil da célula. Quando a célula constrói proteínas que pertencem ao lisossoma, ele corrige esses açúcares para garantir que eles cheguem ao seu destino. "Manose-6-fosfato atua como um código postal, "disse Banik." Esses açúcares dizem à célula, “Estou levando essa proteína para o lisossoma. Por favor, mande-me lá. '"Existem receptores na superfície da célula que interagem com este revestimento de açúcar, e quando eles agarram uma molécula de LYTAC e a puxam para dentro da célula, as proteínas marcadas são arrastadas junto com ele.
Ao anexar este rótulo às proteínas, Os LYTACs sequestram um mecanismo de transporte celular natural projetado para escoltar proteínas lisossomais recém-sintetizadas para seu novo lar. Mas enquanto as proteínas lisossomais são resistentes o suficiente para sobreviver às enzimas degradativas que encontram no lisossoma, a maioria das proteínas não são, portanto, aqueles marcados pelo método LYTAC geralmente são destruídos.
Os pesquisadores de Stanford mostram que, nas células, eles podem atingir e degradar proteínas importantes na doença de Alzheimer e no câncer. De acordo com eles, a extremidade de ligação de proteína do LYTAC pode ser qualquer coisa que se liga a uma proteína, como um anticorpo ou uma droga existente, então no futuro, muitas outras proteínas e doenças poderiam ser atacadas.
"Com estratégias de degradação de proteínas, você pode não só expandir o que é drogável, mas também melhorar as terapias que já existem, "disse Bertozzi." Cada célula tem lisossomas. Cada célula já tem uma maneira de degradar proteínas. Não importa qual seja o seu alvo, se você conseguir um LYTAC lá, você pode degradá-lo. "