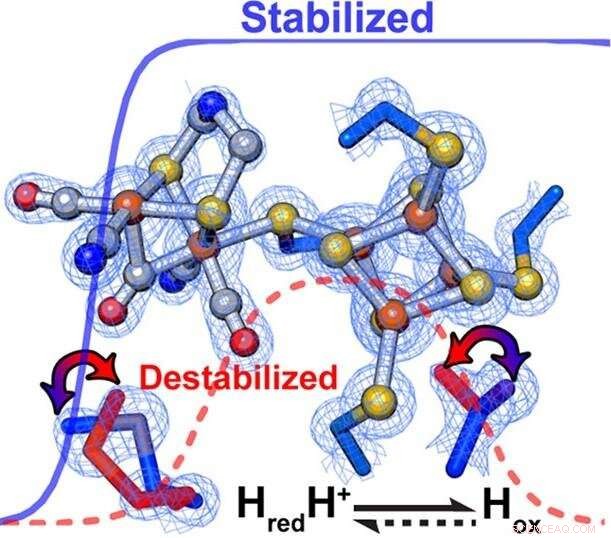
Os pesquisadores descobriram que mudanças sutis no esqueleto da proteína em torno do centro catalítico de uma enzima controlam perfeitamente a taxa e a direção das reações químicas. Dentro de [FeFe] -hidrogenases, as interações secundárias influenciaram diretamente a relativa estabilização / desestabilização de diferentes estados de oxidação do aglomerado de metal do sítio ativo. Crédito:PNNL
À medida que os pesquisadores procuram maneiras de desenvolver e melhorar produtos de uso diário, desde combustíveis a medicamentos, as enzimas fornecem o exemplo natural do controle necessário para fazer as reações químicas funcionarem da maneira desejada. Mas um fenômeno conhecido como viés catalítico continua a confundir os cientistas.
A estrutura da proteína em torno do núcleo catalítico de uma enzima controla primorosamente a reatividade, incluindo a direção e velocidade dos processos químicos. Os cientistas se referem a esse ajuste fino como "tendência catalítica" - e como isso ocorre permanece amplamente debatido.
O mistério está um passo mais perto de ser resolvido.
Uma equipe de pesquisa de três laboratórios nacionais do Departamento de Energia dos EUA (DOE) e quatro universidades descobriram que mudanças sutis no ambiente em torno de algumas enzimas podem não apenas alterar a taxa de uma reação celular em incríveis seis ordens de magnitude, mas também sua direção. Essa reversão - a raiz do dilema do viés catalítico - é como acelerar em uma direção a 10 milhas por segundo, então indo na direção oposta em 1, 000, 000 milhas por segundo. A lacuna aumenta rapidamente.
"Dependendo do resultado desejado, o preconceito pode ser intransponível ou uma das melhores coisas que já aconteceram, "disse Simone Raugei, cientista computacional do PNNL e co-autor do estudo. "Uma reação pode ter muitos intermediários e pode seguir vários caminhos - alguns mais eficientes do que outros. Portanto, ser capaz de ajustar o ambiente do catalisador pode fazer uma diferença notável na taxa de reação."
As evidências, relatado no Jornal da American Chemical Society , têm implicações significativas para o projeto de catalisadores sintéticos usados em ambientes industriais, onde prever e controlar o comportamento de uma reação é crítico. Os resultados também fornecem uma maior compreensão fundamental dos fatores que controlam os processos metabólicos em toda a vida.
Viés catalítico em metaloenzimas
Na natureza, o micróbio Clostridium pasteurianum (Cp) produz várias enzimas à base de ferro, [FeFe] -hidrogenases, que estão entre um grande grupo de metaloenzimas. As metaloenzimas estão envolvidas em uma infinidade de reações que têm muitas funções, como mover hidrogênio através de comunidades microbianas, pegando nitrogênio do ar, produzindo metano, e conversão de carboidratos.
A versatilidade faz com que as metaloenzimas, e [FeFe] -hidrogenases especificamente, assuntos ideais para explorar questões fundamentais relacionadas às transformações químicas. Na verdade, hidrogenases têm sido a fonte de inspiração para numerosos estudos de eletrocatálise em reações de conversão de energia financiados pelo Escritório de Ciências Básicas de Energia do DOE, disse Morris Bullock, diretor do Centro de Eletrocatálise Molecular, um DOE Energy Frontier Research Center.
"As descobertas relatadas por diferentes grupos de pesquisa usando abordagens complementares enriquecem nossa compreensão da base científica fundamental da catálise por sistemas biológicos e moleculares, "disse Bullock.
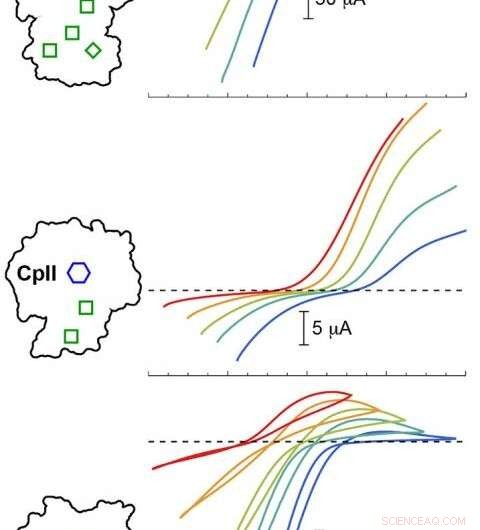
A modelagem computacional PNNL validou experimentos com três hidrogenases Cp em diferentes valores de pH. Os resultados mostraram que o potencial catalítico (curvas coloridas) variou dependendo da disposição do H-Cluster (hexágono azul) e dos clusters acessórios (caixas verdes). Traços coloridos abaixo da linha tracejada correspondem à produção de hidrogênio, enquanto os traços acima da linha tracejada correspondem à oxidação do hidrogênio. Crédito: Geléia. Chem. Soc . 2020, 142, 3, 1227-1235
John Peters, nomeado pelo PNNL, é professor da Washington State University (WSU) e diretor de Transferência e Catálise Biológica e Eletrônica, outro centro de pesquisa do DOE Energy Frontier. Peters começou a estudar [FeFe] -hidrogenases no final dos anos 1990 usando enzimas encontradas no micróbio Cp. Mas esses estudos anteriores focaram em aspectos mecanicistas gerais, e apenas recentemente os pesquisadores começaram a pensar sobre as enzimas no contexto do viés catalítico.
Peters e Paul King, gerente do Grupo de Bioquímica Física e Fotossíntese do Laboratório Nacional de Energia Renovável (NREL), co-projetou o novo estudo com Raugei no PNNL e Anne Jones, professor associado da Escola de Ciências Moleculares da Arizona State University (ASU).
O estudo teve como objetivo identificar como três [FeFe] -hidrogenases diferem no controle da redução de prótons em hidrogênio molecular, bem como a reação reversa - oxidação do hidrogênio molecular em prótons. Cada reação chamada redox desempenha um papel crítico na transferência de energia biológica e tem sido amplamente estudada para armazenamento de energia e aplicações de produção.
Intermediários de reação de ajuste fino de eletrostática
O estudo da atividade catalítica das três [FeFe] hidrogenases envolveu uma poderosa combinação de abordagens experimentais em numerosas instalações de pesquisa e realizada por cientistas da WSU, NREL e ASU. Raugei, também nomeado em conjunto na WSU, liderou a equipe de modelagem teórica e computacional, cujo trabalho era classificar as observações experimentais e desenvolver um modelo teórico para o mecanismo enzimático.
A equipe de pesquisa usou medições precisas de raios-X na instalação Linac Coherent Light Source, localizado na fonte de luz de radiação síncrotron de Stanford, para analisar a estrutura atômica da enzima. Próximo, pesquisadores da ASU submeteram a enzima a uma corrente elétrica para examinar a atividade eletrocatalítica de cada hidrogenase em ambos os estados de repouso e ativo. Todas as enzimas compartilhavam um agrupamento catalítico idêntico de átomos de ferro e enxofre - geralmente chamado de agrupamento H - mas diferiam na composição do ambiente proteico circundante.
Os pesquisadores notaram diferenças significativas no viés da reação entre as três hidrogenases. Então, durante os loops de feedback entre os experimentos e a modelagem computacional, mudanças sutis no campo eletrostático ao redor do centro catalítico chamaram a atenção da equipe.
"Vimos de fato que, se o campo fosse alterado, fomos capazes de conduzir a reação mais favoravelmente de uma forma ou de outra para tentar explicar a observação experimental, "disse Raugei. As diferenças sutis no ambiente, ele disse, determinou a direção da reação em condições de estado estacionário e ajustou a taxa de reação.
De acordo com King, a estabilização ou desestabilização seletiva de intermediários catalíticos promoveu preferencialmente a oxidação do hidrogênio ou a redução do próton. Especificamente, um ambiente mais hidrofóbico em torno do H-Cluster ajustou a enzima para favorecer preferencialmente a produção de hidrogênio, enquanto a oxidação do hidrogênio foi favorecida por um ambiente menos hidrofóbico.
"Este trabalho, "disse o rei, "revela o poder da biologia para controlar a reatividade das metaloenzimas para atender os processos metabólicos únicos em toda a vida e fornece uma nova visão valiosa para o projeto de plataformas eletrocatalíticas aprimoradas."
Peters disse que as características do projeto que [FeFe] -hidrogenases usam para ajustar e controlar a reatividade são provavelmente compartilhadas entre outros biocatalisadores de sítios de metal. Os pesquisadores planejam refinar seu modelo para fornecer um projeto mais geral para a compreensão do viés catalítico na classe maior de enzimas redox - e a energia metabólica que impulsiona toda a vida.