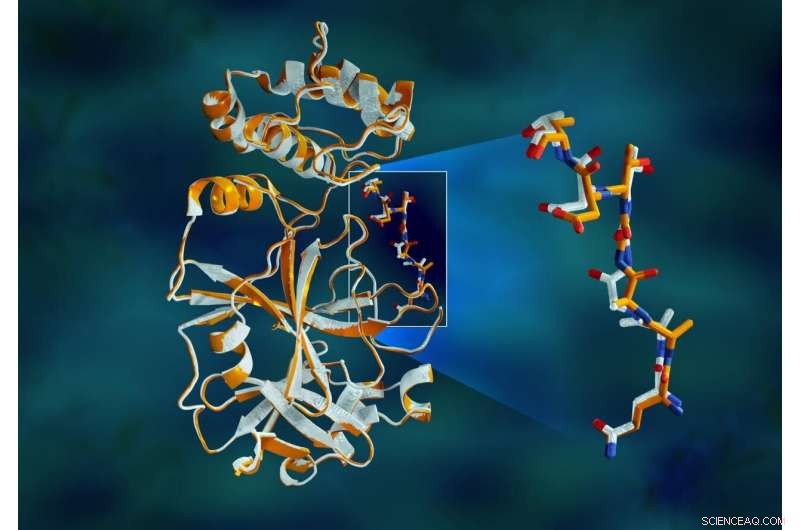
Dados de raios-X sobrepostos da protease principal do SARS-CoV-2 mostram diferenças estruturais entre a proteína à temperatura ambiente (laranja) e a estrutura criogenicamente congelada (branco). Crédito:Jill Hemman / ORNL, Departamento de Energia dos EUA
Uma equipe de pesquisadores dos laboratórios nacionais Oak Ridge e Argonne do Departamento de Energia realizou as primeiras medições de raios-X à temperatura ambiente na protease principal do SARS-CoV-2 - a enzima que permite a reprodução do vírus.
As medições de raios-X marcam um primeiro passo importante no objetivo final dos pesquisadores de construir um modelo 3-D abrangente da proteína enzimática. O modelo será usado para fazer simulações de supercomputação com o objetivo de encontrar inibidores de drogas para bloquear o mecanismo de replicação do vírus e ajudar a acabar com a pandemia de COVID-19. Os resultados de suas pesquisas estão disponíveis publicamente e foram publicados na revista Nature Communications .
SARS-CoV-2 é o vírus que causa a doença COVID-19. O vírus se reproduz expressando longas cadeias de proteínas que devem ser cortadas em comprimentos menores pela enzima protease.
"A protease é indispensável para o ciclo de vida do vírus. A proteína tem a forma de um coração de dia dos namorados, mas é realmente o coração do vírus que permite que ele se replique e se espalhe. Se você inibir a protease e parar o coração, o vírus não consegue produzir as proteínas essenciais para sua replicação. É por isso que a protease é considerada um importante alvo de drogas, "disse Andrey Kovalevsky do ORNL, autor correspondente. Embora a estrutura seja conhecida por cristais preservados criogenicamente, “Esta é a primeira vez que a estrutura desta enzima foi medida à temperatura ambiente, o que é significativo porque está perto da temperatura fisiológica em que as células operam. "
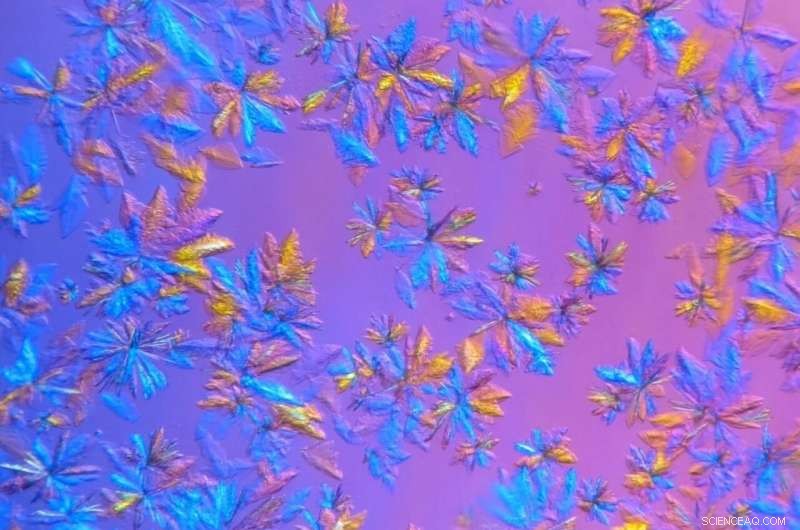
Cristais de protease SARS-CoV-2, cultivado no laboratório de Cristalização e Caracterização de Proteínas do ORNL e retratado em visão microscópica, será usado em experimentos de espalhamento de raios-X. Crédito:Daniel Kneller / ORNL, Departamento de Energia dos EUA
Construir um modelo completo da estrutura da proteína requer a identificação de cada elemento dentro da estrutura e como eles estão organizados. Os raios X são ideais para detectar elementos pesados, como carbono, átomos de nitrogênio e oxigênio. Por causa da intensidade dos feixes de raios-X na maioria das instalações síncrotron de grande escala, as amostras biológicas normalmente devem ser congeladas criogenicamente a cerca de 100 K, ou aproximadamente menos 280 graus Fahrenheit, para suportar a radiação tempo suficiente para que os dados sejam coletados.
Para estender a vida útil das amostras de proteínas cristalizadas e medi-las em temperatura ambiente, Os pesquisadores do ORNL cultivaram cristais maiores do que o necessário para estudos criogênicos de síncrotron e usaram uma máquina de raios-X interna que apresenta um feixe menos intenso.
"Cultivar cristais de proteína e coletar dados é um processo tedioso e demorado. No tempo que normalmente leva para preparar e enviar a amostra para um síncrotron, fomos capazes de fazer crescer os cristais, faça as medições e comece a analisar os dados, "disse Daniel Kneller do ORNL, o primeiro autor do estudo. "E, quando há uma pandemia com muitos cientistas se mobilizando para estudar este problema, não há um dia de sobra. "
A enzima protease consiste em cadeias de aminoácidos com um padrão repetitivo de átomos de nitrogênio-carbono-carbono que formam a espinha dorsal da proteína. Grupos laterais dos blocos de construção de aminoácidos, ou "resíduos, "estendem-se de cada um dos átomos de carbono da estrutura central. A enzima é dobrada em uma forma 3-D específica, criando bolsões especiais onde uma molécula de droga se fixaria.
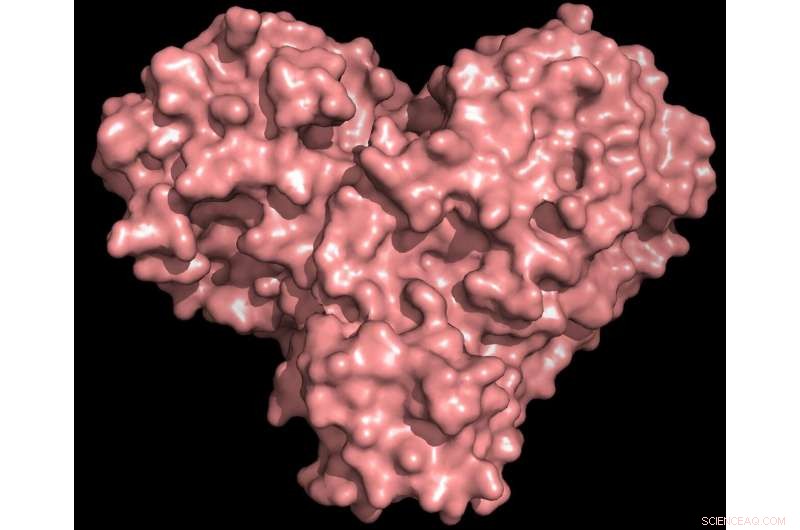
A proteína protease tem a forma de um coração e funciona como um, permitindo que o vírus se replique e se espalhe. A inibição da protease bloquearia a reprodução do vírus. Crédito:Crédito:Andrey Kovalevsky / ORNL, Departamento de Energia dos EUA
O estudo revelou disparidades estruturais significativas entre as orientações do backbone e alguns dos resíduos nas amostras à temperatura ambiente e criogênicas. A pesquisa sugere que o congelamento dos cristais pode introduzir artefatos estruturais que podem resultar em uma compreensão menos precisa da estrutura da protease.
Os resultados da equipe estão sendo compartilhados com os pesquisadores, liderado pelo Presidente do Governador da ORNL-University of Tennessee, Jeremy Smith, que estão conduzindo simulações de ancoragem de drogas usando Summit no ORNL - o supercomputador mais rápido do país.
"O que os pesquisadores estão fazendo na Summit é pegar compostos conhecidos de drogas e tentar ligá-los computacionalmente à protease principal para reaproveitamento de drogas, além de procurar novas pistas para outros candidatos a medicamentos em potencial, "disse o autor correspondente do ORNL, Leighton Coates." Nossos dados de temperatura ambiente estão sendo usados para construir um modelo mais preciso para essas simulações e melhorar as atividades de design de medicamentos. "
O próximo passo dos pesquisadores para completar o modelo 3-D da protease principal SARS-CoV-2 é usar o espalhamento de nêutrons no reator de isótopo de alto fluxo do ORNL e na fonte de nêutrons de espalação. Os nêutrons são essenciais para localizar os átomos de hidrogênio, que desempenham um papel crítico em muitas das funções catalíticas e esforços de design de drogas.
O DNA do plasmídeo protease usado para fazer a enzima foi fornecido pelo Centro de Biologia Estrutural de Argonne na Advanced Photon Source. A cristalização das proteínas utilizadas nos experimentos de espalhamento de raios-X foi realizada no Centro de Biologia Estrutural e Molecular do ORNL.