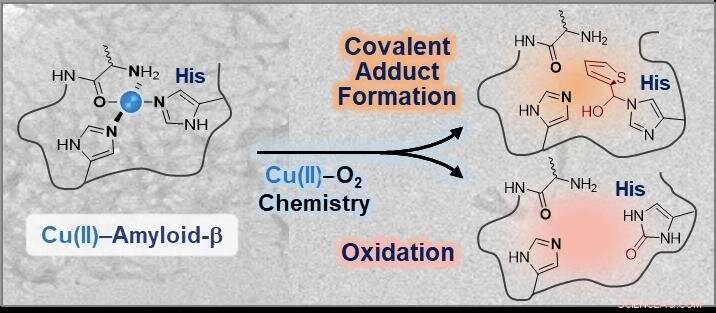
Modificações químicas da esfera de coordenação em Cu (II) -amilóide-β utilizando química cobre-O2. Crédito:KAIST
Tornou-se evidente recentemente que as interações entre cobre e β-amiloide têm um impacto neurotóxico no cérebro de pacientes com doença de Alzheimer. Os pesquisadores do KAIST relataram uma nova estratégia para alterar a neurotoxicidade na doença de Alzheimer, usando um reagente químico projetado racionalmente.
Esta estratégia, desenvolvido pelo Professor Mi Hee Lim do Departamento de Química, pode modificar a esfera de coordenação do cobre ligado ao amiloide-β, inibindo efetivamente a ligação do cobre ao amiloide-β e alterando sua agregação e toxicidade. Seu estudo foi apresentado em PNAS mês passado.
Os pesquisadores desenvolveram uma pequena molécula que é capaz de interagir diretamente com a esfera de coordenação dos complexos cobre-amiloide-β, seguida por modificações por meio de conjugação covalente, oxidação, ou ambos sob condições aeróbicas. A equipe de pesquisa simplesmente utilizou a química do cobre-dioxigênio para projetar um reagente químico.
Responder como as modificações de peptídeos por uma pequena molécula ocorrem continua sendo um grande desafio. O sistema inclui metais de transição e proteínas amiloidogênicas e é bastante heterogêneo, uma vez que eles estão sendo continuamente alterados. É fundamental verificar cuidadosamente as múltiplas variáveis, como a presença de dioxigênio e o tipo de íons de metal de transição e proteínas amiloidogênicas, a fim de identificar os mecanismos subjacentes e a especificidade alvo do reagente químico.
A equipe de pesquisa empregou vários métodos biofísicos e bioquímicos para determinar os mecanismos de modificações na esfera de coordenação dos complexos cobre-Aβ. Entre eles, modificações de peptídeos foram principalmente analisadas usando espectrometria de massa de ionização por eletrospray.
A espectrometria de massa (MS) foi aplicada para verificar essas modificações de peptídeo calculando a mudança na massa exata. A equipe de pesquisa também realizou a dissociação induzida por colisão (CID) do íon alvo detectado por MS para identificar qual resíduo de aminoácido foi especificamente modificado. O CID fragmenta a ligação amida localizada entre os resíduos de aminoácidos. Esta análise fragmentada nos permite identificar os locais específicos de modificações de peptídeos.

Professor Lim (à esquerda) e candidato a PhD Han. Crédito:Instituto Avançado de Ciência e Tecnologia da Coreia (KAIST)
Os complexos de cobre e amiloide-β representam uma conexão patológica entre íons metálicos e amiloide-β na doença de Alzheimer. Descobertas recentes indicam que o cobre e o β-amiloide podem contribuir diretamente para a neurodegeneração, produzindo oligômeros β-amilóide tóxicos e espécies reativas de oxigênio.
Professor Lim disse, "Este estudo ilustra a primeira evidência experimental de que o 14º resíduo de histidina em complexos cobre-amiloide-β pode ser modificado especificamente por meio de conjugação covalente, oxidação, ou ambos. Considerando as implicações neurotóxicas das interações entre cobre e amiloide-β, tais modificações na esfera de coordenação do cobre em β-amiloide podem alterar efetivamente suas propriedades e toxicidade. "
"Este estudo multidisciplinar com ênfase nas abordagens, reatividades, e mecanismos espera abrir uma nova maneira de desenvolver candidatos a doenças anti-neurodegenerativas, "Ela acrescentou. A Fundação Nacional de Pesquisa da Coréia financiou essa pesquisa.