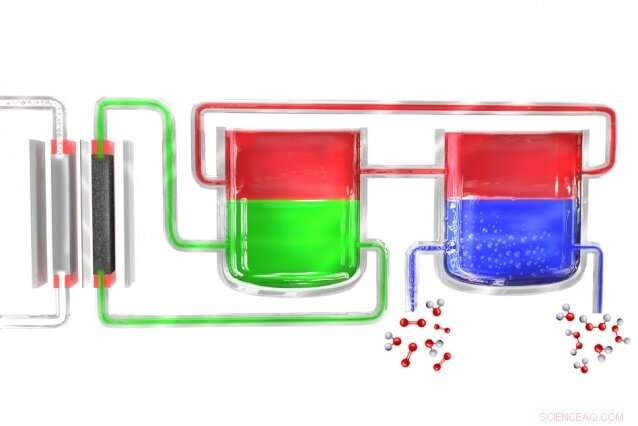
Em um novo método para produzir peróxido de hidrogênio portável, um eletrolisador (à esquerda) divide a água em hidrogênio e oxigênio. Os átomos de hidrogênio inicialmente se formam em um material eletrolítico (verde), que os transfere para um material mediador (vermelho), que os carrega para uma unidade separada onde o mediador entra em contato com água rica em oxigênio (azul), onde o hidrogênio se combina com ele para formar o peróxido de hidrogênio. O mediador então retorna para iniciar o ciclo novamente. Crédito:Massachusetts Institute of Technology
Peróxido de hidrogênio, um desinfetante útil para todos os fins, é encontrado na maioria dos armários de remédios no mundo desenvolvido. Mas em vilas remotas em países em desenvolvimento, onde pode desempenhar um papel importante na saúde e saneamento, pode ser difícil de conseguir.
Agora, um processo desenvolvido no MIT pode levar a um processo simples, barato, dispositivo portátil que pode produzir peróxido de hidrogênio continuamente apenas a partir do ar, agua, e eletricidade, fornecendo uma maneira de esterilizar feridas, superfícies de preparação de alimentos, e até mesmo suprimentos de água.
O novo método é descrito esta semana na revista Joule em um artigo de estudantes do MIT Alexander Murray, Sahag Voskian, e Marcel Schreier e os professores do MIT, T. Alan Hatton e Yogesh Surendranath.
Mesmo em baixas concentrações, o peróxido de hidrogênio é um agente antibacteriano eficaz, e depois de realizar sua função esterilizante, ele se decompõe em água pura, em contraste com outros agentes, como o cloro, que podem deixar subprodutos indesejados de sua produção e uso.
O peróxido de hidrogênio é apenas água com um átomo de oxigênio extra agregado - é H2O2, em vez de H2O. Esse oxigênio extra é relativamente frouxamente ligado, tornando-o um produto químico altamente reativo, ansioso para oxidar quaisquer outras moléculas ao seu redor. É tão reativo que em altas concentrações pode ser usado como combustível de foguete, e mesmo concentrações de 35 por cento requerem procedimentos muito especiais de manuseio e transporte. O tipo usado como desinfetante doméstico é normalmente apenas 3% de peróxido de hidrogênio e 97% de água.
Porque altas concentrações são difíceis de transportar, e baixas concentrações, sendo principalmente água, são antieconômicos de enviar, o material costuma ser difícil de conseguir em lugares onde poderia ser especialmente útil, como comunidades remotas com água não tratada. (As bactérias no abastecimento de água podem ser efetivamente controladas pela adição de peróxido de hidrogênio.) Como resultado, muitos grupos de pesquisa em todo o mundo têm buscado abordagens para desenvolver alguma forma de equipamento portátil de produção de peróxido de hidrogênio.
A maior parte do peróxido de hidrogênio produzido no mundo industrializado é feito em grandes fábricas de produtos químicos, onde metano, ou gás natural, é usado para fornecer uma fonte de hidrogênio, que então reage com o oxigênio em um processo catalítico sob alta temperatura. Este processo consome muita energia e não é facilmente escalonável, exigindo grandes equipamentos e um suprimento constante de metano, portanto, não se presta a unidades menores ou locais remotos.
"Há uma comunidade crescente interessada em peróxido de hidrogênio portátil, "Surendranath diz, "devido ao reconhecimento de que realmente atenderia a muitas necessidades, tanto no lado industrial quanto em termos de saúde humana e saneamento. "
Outros processos desenvolvidos até agora para sistemas potencialmente portáteis têm limitações importantes. Por exemplo, a maioria dos catalisadores que promovem a formação de peróxido de hidrogênio a partir do hidrogênio e do oxigênio também produzem muita água, levando a baixas concentrações do produto desejado. Também, processos que envolvem eletrólise, como este novo processo faz, muitas vezes têm dificuldade em separar o peróxido de hidrogênio produzido do material eletrolítico usado no processo, novamente levando a baixa eficiência.
Surendranath e o restante da equipe resolveram o problema dividindo o processo em duas etapas distintas. Primeiro, eletricidade (idealmente de células solares ou moinhos de vento) é usada para quebrar a água em hidrogênio e oxigênio, e o hidrogênio então reage com uma molécula "portadora". This molecule—a compound called anthroquinone, in these initial experiments—is then introduced into a separate reaction chamber where it meets with oxygen taken from the outside air, and a pair of hydrogen atoms binds to an oxygen molecule (O2) to form the hydrogen peroxide. No processo, the carrier molecule is restored to its original state and returns to carry out the cycle all over again, so none of this material is consumed.
The process could address numerous challenges, Surendranath says, by making clean water, first-aid care for wounds, and sterile food preparation surfaces more available in places where they are presently scarce or unavailable.
"Even at fairly low concentrations, you can use it to disinfect water of microbial contaminants and other pathogens, " Surendranath says. And, he adds, "at higher concentrations, it can be used even to do what's called advanced oxidation, " where in combination with UV light it can be used to decontaminate water of even strong industrial wastes, for example from mining operations or hydraulic fracking.
Então, por exemplo, a portable hydrogen peroxide plant might be set up adjacent to a fracking or mining site and used to clean up its effluent, then moved to another location once operations cease at the original site.
In this initial proof-of-concept unit, the concentration of hydrogen peroxide produced is still low, but further engineering of the system should lead to being able to produce more concentrated output, Surendranath says. "One of the ways to do that is to just increase the concentration of the mediator, and fortunately, our mediator has already been used in flow batteries at really high concentrations, so we think there's a route toward being able to increase those concentrations, " ele diz.
"It's kind of an amazing process, " ele diz, "because you take abundant things, agua, air and electricity, that you can source locally, and you use it to make this important chemical that you can use to actually clean up the environment and for sanitation and water quality."
"The ability to create a hydrogen peroxide solution in water without electrolytes, salt, base, etc, all of which are intrinsic to other electrochemical processes, is noteworthy, " says Shannon Stahl, a professor of chemistry at the University of Wisconsin, who was not involved in this work. Stahl adds that "Access to salt-free aqueous solutions of H2O2 has broad implications for practical applications."
Stahl says that "This work represents an innovative application of 'mediated electrolysis.' Mediated electrochemistry provides a means to merge conventional chemical processes with electrochemistry, and this is a particularly compelling demonstration of this concept. … There are many potential applications of this concept."
Esta história foi republicada por cortesia do MIT News (web.mit.edu/newsoffice/), um site popular que cobre notícias sobre pesquisas do MIT, inovação e ensino.