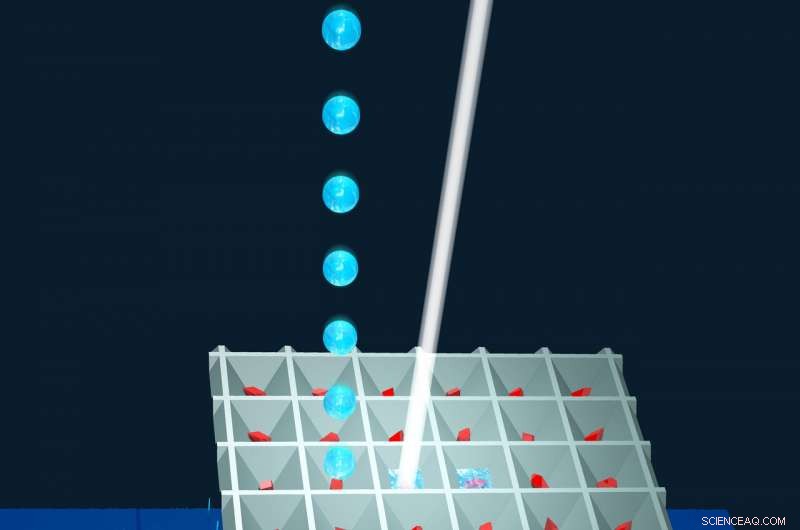
O 'Método de aplicação de líquido para análises resolvidas no tempo' (LAMA) abre a porta para todos os sistemas de cristal de proteína que podem ser difundidos. Crédito:Joerg M. Harms, MPSD
Pesquisadores do Departamento de Dinâmica Resolvida Atomicamente do Instituto Max Planck para a Estrutura e Dinâmica da Matéria (MPSD) no Centro de Ciência do Laser de Elétrons Livres em Hamburgo, a Universidade de Hamburgo e a estação externa do Laboratório Europeu de Biologia Molecular (EMBL) em Hamburgo desenvolveram um novo método para observar as biomoléculas em ação. Este método simplifica drasticamente o início de reações enzimáticas, misturando um coquetel de pequenas quantidades de líquidos com cristais de proteína. A determinação das estruturas da proteína em momentos diferentes após a mistura pode ser montada em uma sequência de lapso de tempo que mostra os fundamentos moleculares da biologia.
As funções das biomoléculas são determinadas por seus movimentos e mudanças estruturais. Ainda assim, é um desafio formidável entender esses movimentos dinâmicos. Um método que os ilumina é a cristalografia de raios-X resolvida no tempo, onde a reação de uma molécula biológica é desencadeada e, em seguida, instantâneos são tirados conforme ela reage. Contudo, desencadear essas reações é extremamente desafiador, pois geralmente envolve lasers e reações de proteínas que podem ser iniciadas pela luz.
O novo 'Método de aplicação de líquido para análises resolvidas com o tempo' (LAMA) supera a necessidade de acionadores ópticos. É adaptado para o estudo de escalas de tempo de reação biologicamente relevantes, que estão na ordem de milissegundos (10 -3 ) para segundos ou até minutos. Essas escalas de tempo são de particular interesse para biólogos e pesquisadores farmacêuticos, pois muitas vezes revelam as mudanças estruturais relevantes para uma função biológica específica ou o turnover de um medicamento. O artigo que descreve o método e sua aplicação acaba de ser publicado em Métodos da Natureza .
Os feixes de raios X microfocados altamente intensos disponíveis na linha de luz EMBL P14-2 permitiram a interrogação do sistema em uma escala de tempo de milissegundos. Mais importante, o novo método 'LAMA' torna todo o experimento muito mais simples do que as abordagens anteriores.
Para iniciar uma reação, alguns picolitros (10 -12 litro) do reagente são misturados com microcristais da proteína alvo. Instantâneos de reação são então registrados à medida que a enzima prossegue com o turnover do reagente. Emocionante, este novo método tem grande potencial em fontes de radiação síncrotron de alto brilho existentes e futuras, permitindo que muitos mais pesquisadores realizem estudos de cristalografia resolvidos no tempo.
O método 'LAMA' já foi implementado como uma opção geralmente acessível na nova estação final de cristalografia macromolecular resolvida no tempo na linha de luz EMBL P14-2 no síncrotron PETRA III em DESY.
Muitos outros insights importantes sobre os processos bioquímicos surgirão com a aplicação dessas tecnologias de ponta. Seu uso nos permitirá responder a algumas das perguntas mais urgentes sobre as principais questões ambientais ou de saúde.