 p Um modelo da proteína CaMKII mostra vários domínios que permitem que ela se ligue aos filamentos de actina nos dendritos dos neurônios em feixes, dando aos dendritos sua forma. Pesquisadores da Rice University, a Universidade de Houston e o Centro de Ciências da Saúde da Universidade do Texas em Houston acreditam que o complexo é a chave para a formação da memória de longo prazo. Crédito:Wolynes Research Lab / Rice University
p Um modelo da proteína CaMKII mostra vários domínios que permitem que ela se ligue aos filamentos de actina nos dendritos dos neurônios em feixes, dando aos dendritos sua forma. Pesquisadores da Rice University, a Universidade de Houston e o Centro de Ciências da Saúde da Universidade do Texas em Houston acreditam que o complexo é a chave para a formação da memória de longo prazo. Crédito:Wolynes Research Lab / Rice University
p Uma nova peça de um quebra-cabeça difícil - a natureza da memória - se encaixou esta semana com uma dica de como as células cerebrais mudam de estrutura quando aprendem algo. p Interações entre três partes móveis - uma proteína de ligação, uma proteína estrutural e cálcio - são parte do processo pelo qual os sinais elétricos entram nas células neurais e remodelam as estruturas moleculares pensadas para permitir a cognição e o armazenamento de memórias.
p Colegas da Rice University, a Universidade de Houston (UH) e o Centro de Ciências da Saúde da Universidade do Texas em Houston (UTHealth) combinaram teorias, simulações e experimentos para determinar como uma proteína de ligação central - quinase dependente de cálcio-calmodulina II (CaMKII) - se liga e se desassocia do citoesqueleto de um neurônio.
p O relatório da equipe no
Proceedings of the National Academy of Sciences dá os primeiros detalhes claros de como os locais de ligação de CaMKII agem para alinhar os filamentos de actina - a proteína estrutural - em longos, feixes rígidos. Os feixes servem como esqueletos de suporte das espinhas dendríticas, saliências pontiagudas que recebem mensagens químicas por meio de sinapses de outros neurônios.
p Peter Wolynes, um físico teórico da Rice, juntou-se a uma colaboração contínua da física Margaret Cheung da UH e do neurobiologista Neal Waxham da UTHealth, com o objetivo de entender como os sinais passam pelos dendritos, os ramos das células nervosas que transmitem informações entre as células.
p Encontrar a estrutura completa do CaMKII provou ser muito complexo para cristalografia de raios-X, embora partes de sua estrutura fossem conhecidas. Quando combinado com a actina que compõe o citoesqueleto, o sistema também se tornou a maior proteína que Wolynes e sua equipe analisaram por meio de seu programa de previsão de estrutura de proteínas, AWSEM.
p Quando eles terminaram, a estrutura prevista pelo computador foi uma combinação notável para as imagens do microscópio eletrônico bidimensional de Waxham e seu grupo, que mostram claramente que os filamentos de actina paralelos são mantidos juntos, como escada, por degraus de CaMKII.
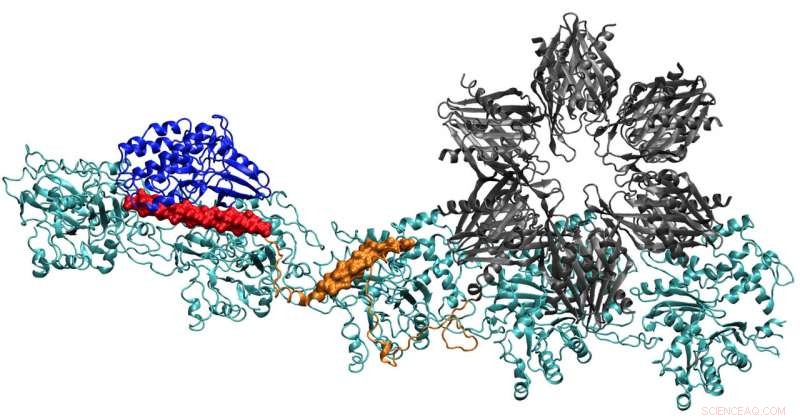
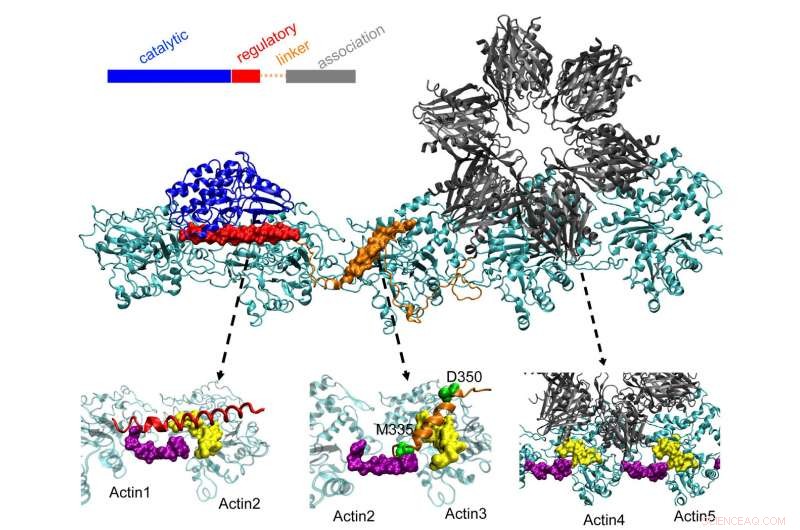 p A proteína CaMKII no topo das docas em três bolsos em filamentos de actina torcidos em neurônios, um processo que pesquisadores da Rice University, a Universidade de Houston e o Centro de Ciências da Saúde da Universidade do Texas em Houston (UTHealth) acreditam que é importante para formar a memória de longo prazo. O domínio regulatório (vermelho) em CaMKII também se liga às proteínas calmodulinas de entrada, que descompacta toda a estrutura da actina e permite que os filamentos agrupados se reorganizem. Crédito:Wolynes Research Lab / Rice University
p A proteína CaMKII no topo das docas em três bolsos em filamentos de actina torcidos em neurônios, um processo que pesquisadores da Rice University, a Universidade de Houston e o Centro de Ciências da Saúde da Universidade do Texas em Houston (UTHealth) acreditam que é importante para formar a memória de longo prazo. O domínio regulatório (vermelho) em CaMKII também se liga às proteínas calmodulinas de entrada, que descompacta toda a estrutura da actina e permite que os filamentos agrupados se reorganizem. Crédito:Wolynes Research Lab / Rice University
p "Definitivamente, existem etapas químicas preliminares envolvendo a atividade enzimática de CaMKII antes de você chegar a este estágio; portanto, não temos uma imagem totalmente clara de como colocar tudo junto, "Wolynes disse." Mas está claro que a montagem do complexo é a etapa chave onde a química se transforma em uma estrutura em maior escala que pode conter uma memória. "
p CaMKII é exclusivamente adequado para interagir com a actina, a proteína mais abundante em células eucarióticas e que tem habilidades especiais em neurônios, onde não só deve dar a milhares de dendritos (em cada um dos bilhões de neurônios) suas formas de repouso, mas também deve dar-lhes um nível de plasticidade para se adaptarem a uma enxurrada constante de sinais.
p As moléculas de actina se auto-montam em longas, filamentos de torção. Os bolsos hidrofóbicos entre essas moléculas são perfeitamente configurados para ligar CaMKII, uma grande proteína com várias partes, ou domínios. Esses domínios bloqueiam em três locais de ligação consecutivos no filamento, e as torções colocam locais de ligação em intervalos regulares para evitar que as proteínas se acumulem.
p O domínio de "associação" de CaMKII é uma subunidade seis vezes que também se liga a filamentos adjacentes para formar feixes de actina, as espinhas dorsais das espinhas dendríticas que dão a essas saliências suas formas.
p Esses feixes permanecem rígidos se o dendrito contiver pouco cálcio. Mas quando os íons de cálcio entram pela sinapse, eles combinam com proteínas calmodulina, permitindo que eles se liguem a outra parte do CaMKII, o domínio regulatório de disquetes. Isso desencadeia a dissociação de um domínio de CaMKII do filamento, seguido pelo resto da proteína, abrindo uma pequena janela de tempo durante a qual os pacotes podem ser reconfigurados.
p "Quando chega cálcio suficiente, a calmodulina ativada quebra essas estruturas, mas só por um tempo, "Wolynes disse." Então as reformas do citoesqueleto. Durante esse tempo, a espinha dendrítica pode assumir uma forma diferente que pode ser maior. "
p "Sabemos que o cálcio traz informações para a célula, "Cheung acrescentou." Mas como as células nervosas sabem o que fazer com isso realmente depende de como essa proteína codifica as informações. Uma parte do nosso trabalho é conectar isso em um nível molecular e, em seguida, projetar como essas regras geométricas simples desenvolvem estruturas em microescala maiores. "
 p Uma imagem de microscópio eletrônico mostra filamentos de actina mantidos juntos em arranjos paralelos ou ramificados por proteínas CaMKII em um neurônio. Simulações e experimentos realizados na Rice University, a Universidade de Houston e o Centro de Ciências da Saúde da Universidade do Texas em Houston mostraram que o espaçamento entre as partículas CaMKII adjacentes nos complexos é quase fixo em 36 nanômetros. A barra de escala é de 100 nanômetros. A imagem foi feita no Structural Biology Imaging Center da McGovern Medical School at UTHealth. Crédito:Waxham Lab / UTHealth
p Uma imagem de microscópio eletrônico mostra filamentos de actina mantidos juntos em arranjos paralelos ou ramificados por proteínas CaMKII em um neurônio. Simulações e experimentos realizados na Rice University, a Universidade de Houston e o Centro de Ciências da Saúde da Universidade do Texas em Houston mostraram que o espaçamento entre as partículas CaMKII adjacentes nos complexos é quase fixo em 36 nanômetros. A barra de escala é de 100 nanômetros. A imagem foi feita no Structural Biology Imaging Center da McGovern Medical School at UTHealth. Crédito:Waxham Lab / UTHealth
p Os cálculos da equipe mostraram que o domínio de associação é responsável por cerca de 40% da força de ligação da proteína à actina. Um domínio de vinculação adiciona outros 40% e o domínio regulatório crucial fornece os 20% finais - uma estratégia sensata, já que o domínio regulatório está à procura de calmodulinas de cálcio que podem descompactar toda a proteína do filamento.
p O projeto surgiu por meio do Centro de Física Teórica Biológica de Rice (CTBP), do qual Wolynes é codiretor e Cheung um cientista sênior. A associação deles remonta a quando ambos estavam na Universidade da Califórnia, San Diego, ele como professor e ela como estudante de graduação do físico do arroz José Onuchic, também codiretor do CTBP. Wolynes também atuou em seu painel de revisão de tese, ela disse.
p Cheung estava ciente do trabalho anterior de Wolynes e seu grupo Rice que sugeriu que a actina estabiliza fibras semelhantes a príons que codificam memórias em neurônios e decidiu que era uma boa combinação para sua pesquisa com Waxham para ver como o cálcio ativa CaMKII.
p "Este é um dos problemas mais interessantes da neurociência:como mudanças químicas de curto prazo levam a algo de longo prazo, Como a memória? ", disse Waxham." Acho que uma das contribuições mais interessantes que fazemos é capturar como o sistema transforma as mudanças que acontecem de milissegundos em segundos e constrói algo que pode sobreviver ao sinal inicial. "
p O quebra-cabeça está longe de estar completo, Wolynes disse. "O trabalho anterior de Margaret e Neal era sobre o início de eventos de memória, "ele disse sobre o estudo de seus colegas sobre a calmodulina." Nosso trabalho sobre o príon foi sobre a preservação da memória, no final do processo de aprendizagem. E a actina está no meio. Pode haver muitas outras coisas no meio, também.
p "Essas questões gerais são interessantes para muitas pessoas, "disse ele." Este é um elemento-chave do problema, mas claramente não é o fim da história. "


