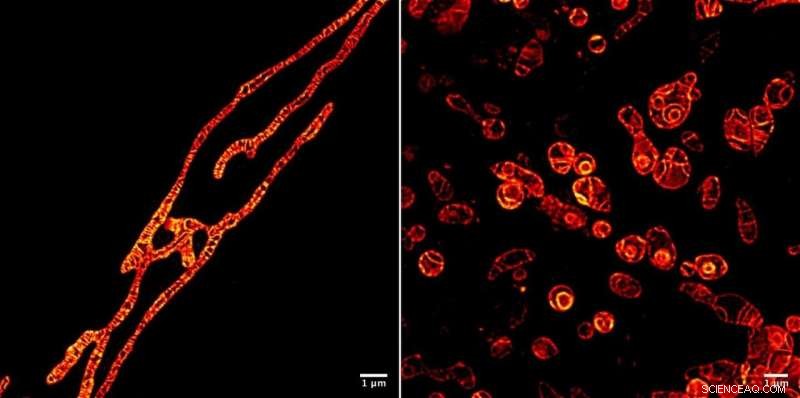
Membranas internas de mitocôndrias vivas sob um microscópio STED fotografadas usando a molécula do marcador fluorescente MitoPB Yellow criada por pesquisadores do Instituto de Bio-moléculas Transformativas (ITbM) da Universidade de Nagoya. As membranas externas da mitocôndria são invisíveis. A molécula marcadora pode resistir ao feixe STED por um tempo relativamente longo, que permite imagens de lapso de tempo do assunto ao vivo. A preparação da amostra é muito mais fácil para um microscópio óptico do que um Microscópio Eletrônico de Transmissão (TEM), exigindo cerca de uma hora em vez de um dia. As células não podem ser visualizadas vivas usando TEM. As mitocôndrias foram tratadas com um reagente que suprime a replicação do DNA, induzindo disfunção, a fim de ver seus processos de sobrevivência (esquerda) e morte (direita). Ser capaz de ver os processos de disfunção que ocorrem dentro das mitocôndrias levará a uma maneira melhor de diagnosticar a doença mitocondrial humana - e talvez até a cura. Crédito:© ITbM, Universidade de Nagoya
A microscopia de luz é a única maneira pela qual podemos olhar dentro de uma célula viva, ou tecidos vivos, em três dimensões. Um microscópio eletrônico dá apenas uma visão bidimensional, e a amostra orgânica queimaria rapidamente devido ao calor extremo do feixe de elétrons, e, portanto, não pode ser observado vivo. Além disso, marcando as biomoléculas da estrutura que nos interessa com uma molécula fluorescente especialmente projetada, podemos distingui-lo dos arredores:isso é microscopia de fluorescência.
Até meados da década de 1990, a microscopia de fluorescência foi dificultada pela física básica:devido ao limite de difração, quaisquer características da amostra mais próximas umas das outras do que cerca de 250 nanômetros seriam borradas juntas. Os vírus e proteínas individuais são muito menores do que isso, então eles não poderiam ser estudados desta forma. Mas por volta de 1994, em uma lição maravilhosa nos ensinando que devemos ter cuidado ao aplicar os princípios físicos fundamentais, Stefan Hell descobriu a microscopia de Depleção de Emissão Estimulada (STED), que agora é uma das várias abordagens de microscopia óptica que alcançam "super-resolução, "resolução além do limite de difração. Ele recebeu o Prêmio Nobel de Química em 2014" pelo desenvolvimento de microscopia de fluorescência super-resolvida, "junto com Eric Betzig e William Moerner.
Para ver por que o limite de difração é um problema, imagine que a estrutura de interesse é muito pequena, dizer, 50 nanômetros de diâmetro, como um vírus, e foi marcado com uma biomolécula fluorescente. Agora imagine iluminá-lo com um ponto de laser, dizer, 200 nanômetros de diâmetro. As moléculas marcadoras iluminadas emitem luz espontaneamente, em momentos aleatórios, por fluorescência, com a probabilidade caindo rapidamente com o tempo. Os fótons de muitas moléculas fluorescentes são focados em um detector usando lentes, criando um único pixel sem características. Não é totalmente brilhante porque apenas uma pequena proporção da amostra no círculo iluminado contém moléculas fluorescentes. Se você movesse o laser 200 nanômetros em qualquer direção, para onde, neste exemplo, nenhuma molécula fluorescente está presente, o sinal certamente ficará escuro. Então, este pixel um tanto escuro nos diz que algo está presente dentro dessa área de amostra de 200 nanômetros de diâmetro. O limite de difração nos impede de formar pixels de áreas menores, se usarmos a abordagem básica.
A ideia física da microscopia STED é muito simples. Com o ponto de laser iluminando a região ao redor da pequena estrutura fluorescente novamente, suponha que você, de alguma forma, evite que a luz seja enviada ao detector de uma área tão grande quanto possível dentro do ponto - deixando um ponto muito menor, dizer, 60 nanômetros de diâmetro. Agora, se você mover o laser 60 nanômetros em qualquer direção e o sinal escurecer, o pixel na imagem representa a presença de uma estrutura de até 60 nanômetros de largura. O limite de difração foi batido. Claro, um desses pixels não tem características, mas uma imagem nítida de mitocôndrias pode ser construída examinando e registrando muitos pixels de brilho variável. (Veja a Figura 1. "Microscopia STED controlada por tempo" foi usada para capturar a maioria das imagens neste documento.)
A descoberta ganhadora do Prêmio Nobel de Stefan Hell consiste em dois insights. Primeiro, ele pensou na ideia de impedir que a luz fosse enviada ao detector de uma área tão grande quanto possível dentro de um ponto iluminado cujo tamanho correspondesse ao limite de difração. Segundo, ele descobriu como realmente alcançá-lo.
Dois lasers iluminam o mesmo local. O primeiro laser excita os elétrons da molécula marcadora e eles decaem espontaneamente de volta ao seu estado fundamental, cada um emitindo um fóton visível de um comprimento de onda específico. (Isso é fluorescência.) O processo é aleatório, com a probabilidade de emissão diminuindo com o tempo de forma bastante rápida, o que significa que a maioria dos fótons são emitidos nos primeiros nanossegundos da amostra sendo iluminada. Um segundo laser, o "feixe STED, "moldado com um orifício no meio para não afetar as moléculas marcadoras lá, é ajustado para estimular a emissão de um fóton pela molécula do marcador excitado no anel externo. Mas como esses fótons são diferenciados dos fótons emitidos do meio?
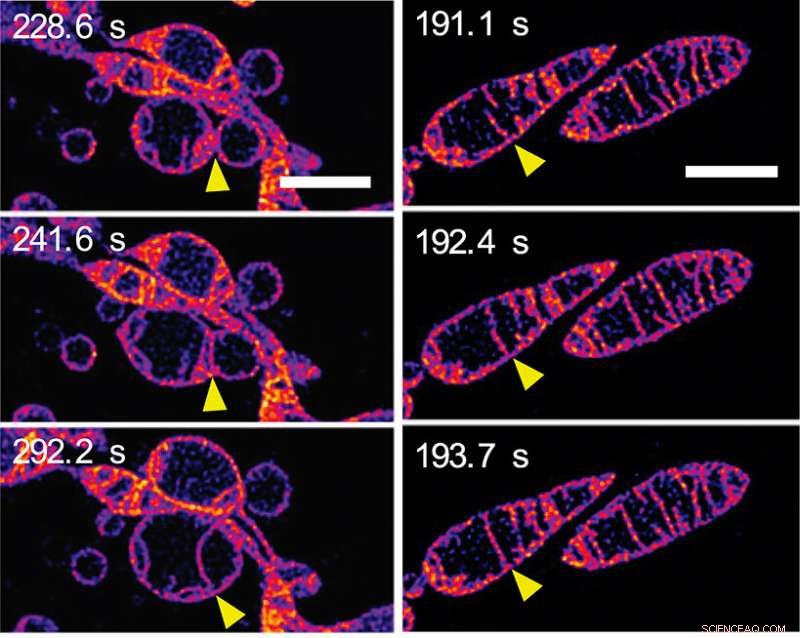
Em resposta a ser privado de nutrientes, as mitocôndrias se fundem e aumentam o número de cristas. (a) Quadros de uma sequência de lapso de tempo mostrando duas mitocôndrias separadas se fundindo para formar uma única mitocôndria. As membranas externas das mitocôndrias são invisíveis:estamos vendo as membranas internas se fundindo. (b) Quadros de uma sequência de lapso de tempo mostrando duas cristas dentro de uma única mitocôndria se fundindo. (Veja o Vídeo 2 no Material Suplementar na página da Web do PNAS do jornal.) As barras de escala representam 2 mm. Crédito:© ITbM, Universidade de Nagoya
O processo de emissão do anel externo também é aleatório, mas acontece muito mais rapidamente, a probabilidade diminuindo rapidamente, o que significa que a maioria desses fótons é emitida em cerca de um nanossegundo. Conforme os dois feixes sobrepostos varrem a amostra, no momento em que o centro do anel está fluorescente, as moléculas circundantes já foram forçadas a seu estado fundamental pela emissão de um fóton - elas foram "desligadas". A técnica de microscopia STED depende de um timing inteligente dessa maneira. Em princípio, o tamanho do ponto central brilhante pode ser tão pequeno quanto você quiser, portanto, qualquer resolução é possível. Contudo, o "feixe STED" em forma de donut estaria então entregando energia na forma de luz laser visível concentrada para uma área maior da célula viva, arriscando matá-lo.
No entanto, o processo não é ideal, e a imagem resultante perde alguma nitidez porque algumas moléculas de marcador no anel externo não estão devidamente desligadas - o processo é probabilístico, afinal - e quando eles apresentam fluorescência, contaminam o sinal do centro. Contudo, devido ao tempo diferente da emissão espontânea e estimulada, os primeiros fótons a chegar ao detector são de regiões iluminadas pela maior intensidade de feixe STED, e os últimos fótons a chegar são provavelmente de moléculas marcadoras localizadas no ponto central. Então, esperando um pouco (cerca de um nanossegundo) antes de gravar a imagem, a maioria dos fótons do anel externo pode ser filtrada. Isso é chamado de "Microscopia STED controlada por tempo". O aumento da nitidez da imagem é obtido por meio de um processo denominado deconvolução.
A invenção da microscopia de super-resolução foi o prenúncio de um salto em frente nas ciências da vida. Organismos vivos podem ser observados em uma resolução sem precedentes. Contudo, As sequências de imagens com lapso de tempo não puderam ser feitas em qualquer período de tempo decente porque as moléculas do marcador se degradariam sob o intenso feixe STED e parariam de fluorescência. Este é o problema do fotodegradação. As moléculas marcadoras danificadas também podem se tornar tóxicas para a célula.
O problema de fotobranqueamento resolvido
Shigehiro Yamaguchi e Masayasu Taki, do Instituto de Biomoléculas Transformativas da Universidade de Nagoya (ITbM), liderou uma equipe de pesquisa que desenvolveu uma molécula marcadora, chamado de "MitoPB Amarelo, "que é absorvido pela membrana interna da mitocôndria, incluindo as cristas - as estruturas em forma de dobra - e tem uma longa vida útil sob uma viga STED. A ideia para a molécula do marcador que visa mitocôndrias veio do co-autor Chenguang Wang, do ITbM. A imagem multicor STED com um único laser STED também é possível; e os pesquisadores esperam que os marcadores fluorescentes semelhantes ao amarelo MitoPB encontrem uma ampla gama de aplicações em outras técnicas de super-resolução (como as desenvolvidas por Eric Betzig e William Moerner).
Para demonstrar a utilidade prática de MitoPB Amarelo para imagens de células vivas, o grupo colocou mitocôndrias em condições que são conhecidas por causar certas mudanças estruturais, mas até agora estas só foram observadas usando microscopia eletrônica de transmissão, que não pode ser usado em células vivas. As mitocôndrias foram tratadas com um reagente que suprime a replicação do DNA, induzindo disfunção, a fim de observar seus processos de sobrevivência e morte.
Então, usando microscopia STED controlada por tempo, a equipe de pesquisa fez imagens estáticas com resolução de 60 nanômetros (cerca de um milésimo da largura de um cabelo humano), bem como sequências de imagens de lapso de tempo mostrando as mitocôndrias respondendo a uma privação de nutrientes ao mudar de forma para sobreviver. As longas sequências de imagens - de até 600 imagens - são as primeiras feitas de mitocôndrias na resolução espacial relativamente alta de 90 nanômetros. (Veja o Vídeo 1, que mostra uma sequência de lapso de tempo registrada ao longo de quase 7 minutos.)
Em alguns minutos, a estrutura mitocondrial interna mudou drasticamente de várias maneiras. Inicialmente, alongamento e aumento no número de cristas. Uma sequência de imagens (ver Figura 2a) mostra membranas internas de mitocôndrias vizinhas se fundindo - em outras palavras, duas mitocôndrias se fundindo para formar uma. Outra sequência de imagens (veja a Figura 2b) mostra duas cristas dentro de uma única mitocôndria aparentemente se fundindo. Acredita-se que o alongamento e a criação de mais cristas aumentem a eficiência da produção de energia (síntese de ATP) enquanto protege o mitocôndrio da "degradação autofagossômica" - uma morte programada cujo objetivo é remover componentes desnecessários ou disfuncionais da célula e permitir a degradação ordenada e a reciclagem de componentes celulares.
Após o período inicial de alongamento, as membranas internas de algumas mitocôndrias se dividiram em glóbulos que aumentaram de tamanho e perderam as cristas (veja o Filme S2); alguns glóbulos se romperam (Filme S4). Algumas formaram esferas concêntricas (Figura 1 e Vídeo 1). A intensidade da fluorescência permaneceu a mesma. Digno de nota aqui é que as cristas e membranas permanecem com imagens tão nítidas quanto antes, o que indica que a causa da morte da mitocôndria não é toxicidade devido à degradação da molécula do marcador sob o feixe. O laser STED extremamente forte pode ter danificado as mitocôndrias, embora exatamente por que eles se rompam seja desconhecido.
Nessas imagens, depois de ver as respostas iniciais de sobrevivência, estamos assistindo à morte de mitocôndrias sob o intenso feixe STED. Uma direção futura de pesquisa será reduzir a intensidade do feixe de laser STED, criando uma molécula marcadora fluorescente que brilha quando iluminada por luz de um comprimento de onda maior e, portanto, de menor energia. A mitocôndria pode então viver mais.
Contudo, mesmo com MitoPB amarelo, o processo de morrer - que não é bem compreendido - pode ser estudado. Ninguém sabe se as alterações morfológicas (estruturais) observadas durante o processo de morte estão relacionadas à apoptose (normal, morte controlada) ou necrose (morte devido a lesão ou mau funcionamento). A apoptose é conhecida por ser desencadeada por uma molécula de sinalização chamada citocromo C:se um reagente pode ser encontrado que suprime o citocromo C, então as mitocôndrias - e as células humanas - poderiam viver mais.
Ser capaz de ver os processos que ocorrem dentro das mitocôndrias deve levar a uma maneira melhor de diagnosticar a doença mitocondrial humana - e talvez até mesmo à cura.