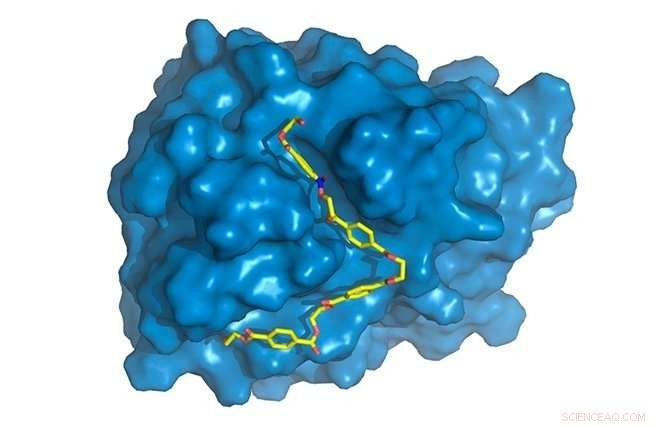
 p PETase é mostrado em azul, com cadeia PET (amarela) ligada ao local ativo, onde será degradado. Crédito:Rodrigo Leandro Silveira
p PETase é mostrado em azul, com cadeia PET (amarela) ligada ao local ativo, onde será degradado. Crédito:Rodrigo Leandro Silveira
p Desde que foi descoberto, a enzima conhecida como PETase despertou grande interesse científico por sua capacidade de digerir PET (tereftalato de polietileno). p Um polímero usado principalmente para fabricar garrafas de bebidas (mas também roupas, tapetes, e outros produtos), O PET tem a desvantagem de ser resistente à degradação. Garrafas e outros objetos feitos de PET (tereftalato de polietileno) levam pelo menos 800 anos para biodegradar em aterros ou no mar. Entre 4,8 bilhões e 12,7 bilhões de quilos de plástico são despejados nos oceanos todos os anos.
p Um estudo com resultados publicados recentemente na revista.
Proceedings of the National Academy of Sciences (
PNAS ) mostrou como uma equipe internacional de colaboradores conseguiu aumentar a capacidade do PETase de decompor o plástico.
p "Em nosso projeto de pesquisa, caracterizamos a estrutura tridimensional da enzima que pode digerir este plástico, projetou para aumentar sua capacidade de degradação, e demonstrou que também atua no polietileno-2, 5-furanodicarboxilato (PEF), um substituto do PET feito de matérias-primas renováveis, disse o coautor Rodrigo Leandro Silveira, Pós-doutorado no Instituto de Química da Universidade Estadual de Campinas (IQ-UNICAMP).
p
Uma bactéria que sobrevive metabolizando PET
p O interesse no PETase surgiu em 2016, quando um grupo de pesquisadores japoneses liderado por Shosuke Yoshida identificou uma nova espécie de bactéria, Ideonella sakaiensis, que pode se alimentar de PET usando-o como fonte de carbono e energia. A bactéria continua sendo o único organismo conhecido com essa capacidade. Literalmente cresce no PET.
p "Além de identificar I. sakaiensis, os cientistas japoneses descobriram que ele produz duas enzimas e as secreta no meio ambiente, "Silveira explicou." Uma das enzimas secretadas é a PETase. Por ter um certo grau de cristalinidade, PET é um polímero muito difícil de decompor. Mas a PETase ataca e decompõe-se em pequenas unidades de ácido mono (2-hidroxietil) tereftálico, ou MHET. As unidades de MHET são então convertidas em ácido tereftálico e absorvidas e metabolizadas pela bactéria. "
p I. Sakaiensis é o único organismo vivo conhecido por usar uma molécula sintética fabricada por humanos para sobreviver. Isso significa que a bactéria é o resultado de um processo evolutivo muito recente que se desenvolveu nas últimas décadas. A bactéria se adaptou a um polímero que foi desenvolvido no início dos anos 1940 e só começou a ser usado em escala industrial na década de 1970. PETase é a chave para entender como.
p "PETase faz a parte mais difícil, que está quebrando a estrutura cristalina e despolimerizando PET em MHET, "disse o pesquisador financiado pela FAPESP." O trabalho feito pela segunda enzima, que converte o MHET em ácido tereftálico, é muito mais simples, porque seu substrato consiste em monômeros que a enzima pode acessar facilmente porque estão dispersos no meio de reação. Por esta razão, a pesquisa se concentrou no PETase. "
p
A enzima modificada liga-se melhor ao polímero
p A próxima etapa foi estudar a PETase em detalhes, a contribuição do novo projeto de pesquisa. "Nós nos concentramos em descobrir o que dá à PETase a capacidade de fazer algo que outras enzimas não podem fazer de forma muito eficiente. Começamos caracterizando a estrutura 3-D dessa proteína, “Silveira explicou.
p "Obter a estrutura 3-D significa descobrir x, coordenadas y e z de cada um dos milhares de átomos que compõem a macromolécula. Nossos colegas britânicos fizeram isso usando uma técnica bem conhecida e amplamente usada chamada difração de raios-X, disponível em um laboratório muito semelhante ao de Sirius, agora em construção em Campinas. ”
p Depois de obter a estrutura 3-D, os pesquisadores começaram a comparar a PETase com proteínas relacionadas. O parente mais próximo é uma cutinase da bactéria Thermobifida fusca que degrada a cutina, uma espécie de verniz natural encontrado nas folhas das plantas. Certos microrganismos patogênicos usam a cutinase para quebrar a barreira da cutina e os nutrientes apropriados nas folhas.
p "Encontramos algumas diferenças específicas na PETase em comparação com a cutinase na região da enzima onde ocorrem as reações químicas, conhecido como site ativo. PETase tem um site ativo mais aberto, por exemplo, "Disse Silveira." Estudamos os movimentos moleculares da enzima por meio de simulações de computador, a parte para a qual mais contribuí. Enquanto estrutura de cristal, obtido por difração de raios-X, forneceu informações estáticas, as simulações nos deram informações dinâmicas e nos permitem descobrir o papel específico de cada aminoácido no processo de degradação do PET ”.
p A física dos movimentos da molécula resulta da atração e repulsão eletrostática de um grande número de átomos e da temperatura. As simulações de computador permitiram aos pesquisadores entender mais completamente como a PETase se liga e interage com o PET.
p “Descobrimos que a PETase e a cutinase têm dois aminoácidos diferentes no sítio ativo. Em seguida, usamos procedimentos de biologia molecular para produzir mutações na PETase com o objetivo de convertê-la em cutinase, “Disse Silveira.
p "Se pudéssemos fazer isso, descobriríamos quais componentes conferiam a ele essa propriedade única de degradar PET. Contudo, para nossa surpresa, quando tentamos suprimir essa atividade específica da PETase - tentando converter a PETase em cutinase - produzimos uma PETase ainda mais ativa. Tentamos reduzir sua atividade, e, em vez disso, o aumentamos. "
p Mais simulações de computador foram necessárias para entender por que a PETase mutante era melhor do que a PETase original. Modelagens e simulações mostraram claramente que as alterações produzidas na PETase original facilitaram a ligação da enzima ao substrato. Essa ligação depende da geometria, com duas moléculas se encaixando como uma chave e um buraco de fechadura, e sobre os fatores termodinâmicos envolvidos nas interações entre os vários componentes da enzima e do polímero. A maneira elegante de descrever isso é que a PETase modificada tem "maior afinidade" pelo substrato.
p Em termos de obtenção de uma enzima que pode digerir toneladas de resíduos plásticos, o estudo foi um grande sucesso, mas por que PETase é PETase permanece um mistério.
