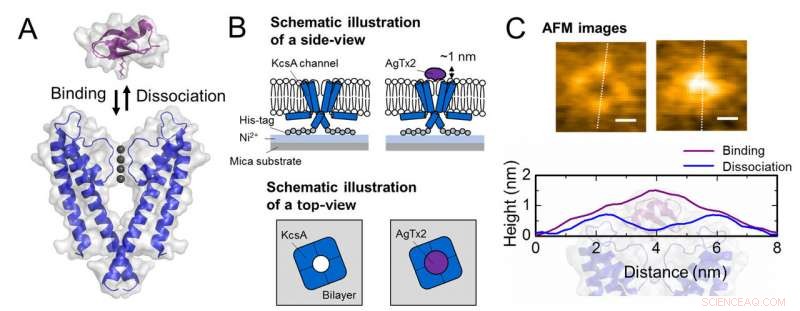
Esquema de associação e dissociação do canal de potássio KcsA (Q58A / T61S / R64D) e AgTx2 e imagens representativas de AFM. A. Associação (ligação) de KcsA e AgTx2. B. Esquema mostrando uma amostra para observação de AFM.
C. Imagens representativas de AFM e com dimensões mostradas como linhas pontilhadas brancas. Barra, 2 nm. Crédito:Kanazawa University
Agitoxin-2 (AgTx2) do veneno de escorpião é um potente bloqueador dos canais de K +. Os pesquisadores agora observaram a dinâmica de ligação do AgTx2 ao canal KcsA usando microscopia de força atômica de alta velocidade. Análises cinéticas de molécula única revelaram que a afinidade do canal para AgTx2 aumentou durante a ligação persistente e diminuiu durante a dissociação persistente. Os pesquisadores propõem um modelo de quatro estados com constantes de taxas relevantes. Uma via de ajuste induzido foi dominante e acelerou a ligação em 400 vezes.
As membranas celulares contêm canais iônicos que regulam a permeação de vários íons entre o interior e o exterior da célula. Canais iônicos são proteínas, e em resposta a diversos estímulos, eles permitem que íons específicos permeiem. Desta forma, a célula regula os sinais elétricos que constituem a base do funcionamento dos músculos e do sistema nervoso. Uma vez que um mau funcionamento dos canais iônicos causa uma série de distúrbios, como infarto do miocárdio e epilepsia, é importante entender o mecanismo de ação das moléculas que dificultam as funções dos canais iônicos.
Descobriu-se que o veneno do escorpião contém mais de 200 compostos que se ligam aos canais de K +. Entre eles, AgTx2 é um peptídeo que consiste em 38 resíduos de aminoácidos. Estudos anteriores mostraram que, ao se ligar ao canal de K + de fora da membrana celular, AgTx2 bloqueia o poro do canal de K + e inibe a permeação de K +. Contudo, o mecanismo molecular detalhado permaneceu desconhecido, por exemplo. se a dinâmica de ligação poderia ser explicada por um modelo de associação e dissociação de dois estados.
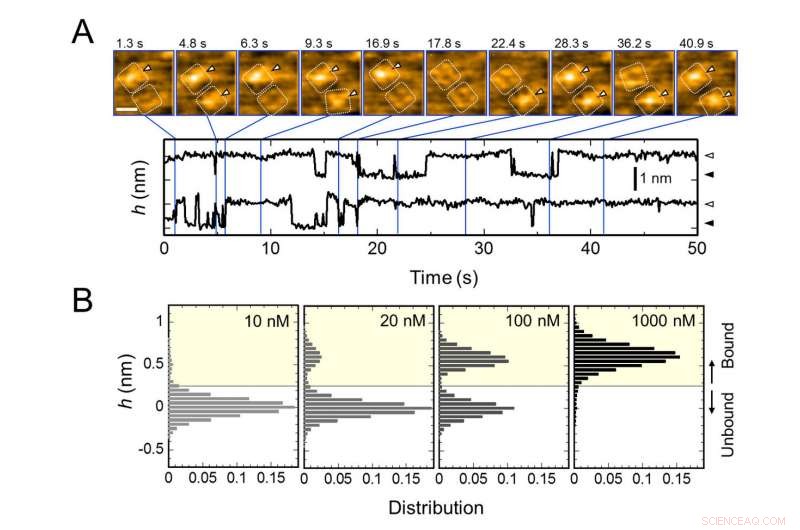
Ligação repetitiva de AgTx2 ao canal de potássio KcsA e AgTx2 - dependência da concentração da probabilidade de ligação. A. Imagens de lapso de tempo de ligação de AgTx2 e dissociação dos canais KcsA e cursos de tempo da altura média (h) (nm) em torno do centro da superfície extracelular. Barra de escala na imagem HS-AFM, 5 nm. B. Histogramas de altura de h dependendo da concentração de AgTx2 na solução. Crédito:Kanazawa University
A equipe de pesquisa, incluindo cientistas da Universidade de Kanazawa, visualizou a associação e dissociação do AgTx2 com o canal de K + KcsA usando microscopia de força atômica de alta velocidade (HS-AFM) e realizou uma análise detalhada da dinâmica (Figura 1). KcsA é um tetrâmero, suas subunidades formando uma estrutura semelhante a um anel. Após a ligação do AgTx2 à superfície do tetrâmero, a parte central do canal, ou seja, a passagem para K +, apareceu inchado devido à ligação de AgTx2. A ligação e dissociação de AgTx2 para o canal de K + pode ocorrer repetidamente e a altura em torno do centro do canal mudou em conformidade (Figura 2).
Quando a concentração de AgTx2 na solução era alta, a probabilidade de ligação também era alta. Os cursos de tempo da ligação e dissociação revelaram que após a ligação de AgTx2 a KcsA, a conformação de KcsA mudou, o que permitiu a ligação do AgTx2 mais facilmente, e que mesmo após a dissociação de AgTx2, outra molécula AgTx2 poderia se ligar a KcsA muito rapidamente; isso é conhecido como mecanismo de ajuste induzido. Por outro lado, foi observado que, quando o tempo suficiente tiver decorrido após a dissociação do AgTx2, a conformação de KcsA mudou de volta ao original, ao qual AgTx2 se ligou menos prontamente.
Esses resultados indicam que a dinâmica de ligação não pode ser explicada com um modelo simples de dois estados, isto é, ligação e dissociação. Parecia que os estados de associação e dissociação de KcsA podiam ser distinguidos como pelo menos dois subestados; um modelo de associação de quatro estados foi, portanto, considerado (Figura 3). Quando as taxas de reação foram calculadas para um modelo de quatro estados, as taxas obtidas refletiram aquelas obtidas experimentalmente. Uma simulação da dinâmica de ligação com este modelo de quatro estados e as taxas de reação associadas, mostraram que a ligação de AgTx2 ocorre principalmente por meio da via de ajuste induzido. Avançar, verificou-se que o ajuste induzido acelerou a ligação de AgTx2 em 400 vezes. Assim, o mecanismo de AgTx2 para inibir eficientemente a função de KcsA foi elucidado (Figura 3).
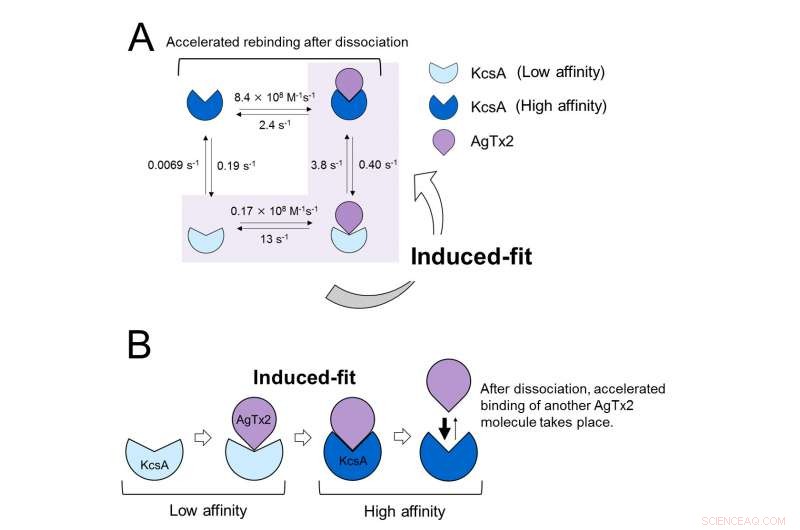
Modelo de dinâmica de ligação de AgTx2 e canal de potássio KcsA. A. Constantes de velocidade das etapas de reação. B. Ligação acelerada de AgTx2 ao canal de potássio KcsA através do mecanismo de ajuste induzido. Crédito:Kanazawa University
A técnica de observação HS-AFM e o método usado para a análise da ligação do canal de K + e o inibidor de peptídeo podem ser aplicados a uma ampla variedade de moléculas biológicas. Eles podem ser aplicados a análises de ligação de um ligante ao seu receptor, bem como à associação de DNA e uma proteína de ligação a DNA. Espera-se que este estudo acelere a elucidação da dinâmica de ligação de várias moléculas biológicas.
O estudo é publicado em Avanços da Ciência .