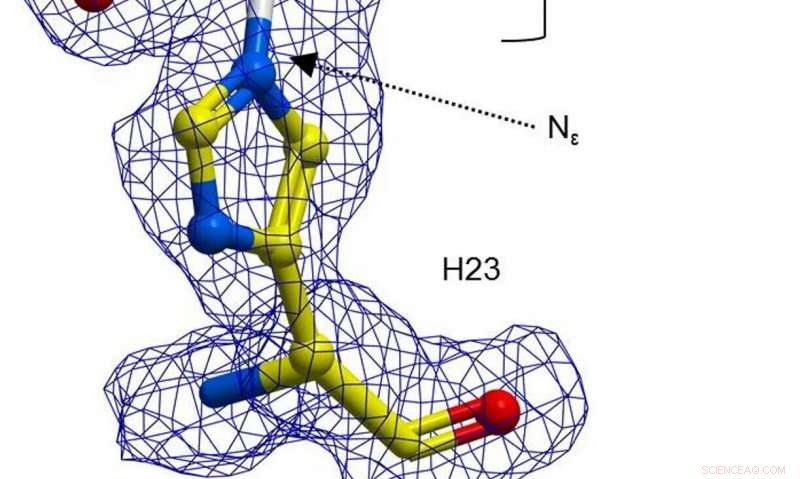
Uma representação esférica de H23 a partir de BH32 inibida com 2-bromoacetofenona, colorido por tipo de átomo com átomos de carbono H23 em amarelo e carbonos de acetofenona em branco. Densidade de elétrons de FEM clara (azul, contornado em 1σ) estende-se entre o Nε de H23 e a acetofenona. Crédito: Natureza (2019). DOI:10.1038 / s41586-019-1262-8
Uma equipe de químicos da Universidade de Manchester encontrou uma maneira de incorporar um resíduo anormal em uma enzima para mostrar como a gama catalítica das enzimas pode ser aumentada. Em seu artigo publicado na revista Natureza , o grupo descreve a expansão da gama de enzimas catalíticas que poderiam ser usadas para fornecer uma variedade mais ampla de cadeias laterais para catálise - usando um "alfabeto" estendido de aminoácidos. Adam Nelson, com a Universidade de Leeds, publicou um artigo News and Views Research discutindo o trabalho da equipe na mesma edição do jornal.
Como observa Nelson, não há muitos resíduos de aminoácidos naturais que podem ser usados por enzimas para catalisar reações - ele observa que existem apenas 20 tipos que podem ser usados para construir tais enzimas. Essa escassez de opções levou os pesquisadores a considerarem se a gama de aminoácidos que poderiam ser usados pelas enzimas para permitir mais reações catalíticas poderia ser ampliada - talvez usando o que os pesquisadores descrevem como um "alfabeto" de aminoácidos que fornecem uma gama mais ampla variedade de cadeias laterais que podem ser usadas para catálise. Neste novo esforço, os pesquisadores empregaram esse alfabeto estendido de aminoácidos para expandir o leque de possibilidades. Eles relatam que, ao fazê-lo, eles foram capazes de construir uma enzima usando membros de um grupo catalítico não natural e mostraram que isso poderia levar a melhorias usando uma abordagem chamada evolução direcionada.
Em seu trabalho, os pesquisadores optaram por remodelar uma enzima para torná-la um catalisador mais eficaz - eles começaram observando que um resíduo de aminoácido histidina na enzima BH32 pode formar um composto intermediário de acil-enzima. Esse intermediário foi hidrolisado para criar um produto da reação, mas o resultado não foi o esperado. Em seguida, a equipe usou a evolução direcionada para otimizar o papel da Nδ-metil-histidina. Isso envolveu uma série de abordagens para forçar mutações. Como resultado, a equipe descobriu uma variante chamada OE1.3, qual teste mostrou ser mais eficiente. A equipe continuou com uma evolução mais direcionada e finalmente chegou a OE1.4 - uma enzima que demonstrou atividade catalítica melhorada.
© 2019 Science X Network