Microesferas de núcleo-casca sub-2 μm funcionalizadas com bis (zinco (II) -dipicolilamina) para a análise de N-fosfoproteoma. Crédito:JIANG Bo e HU Yechen
A fosforilação da proteína N desempenha um papel crítico no metabolismo central e na sinalização de dois / multicomponentes de procariotos. Além disso, ele existe como intermediário de algumas enzimas importantes em mamíferos.
Contudo, os métodos de enriquecimento atuais para O-fosfopeptídeos não são preferidos para N-fosfopeptídeos devido à labilidade intrínseca da ligação P-N sob condições ácidas. Portanto, a análise de N-fosfoproteoma eficaz continua desafiadora.
Recentemente, um grupo de pesquisa liderado pelo Prof. Zhang Lihua e Pro. Zhang Yukui do Instituto Dalian de Física Química (DICP) da Academia Chinesa de Ciências (CAS) propôs uma estratégia de enriquecimento de N-fosfopeptídeos rápida e eficaz.
Seu estudo foi publicado em Nature Communications em 4 de dezembro.
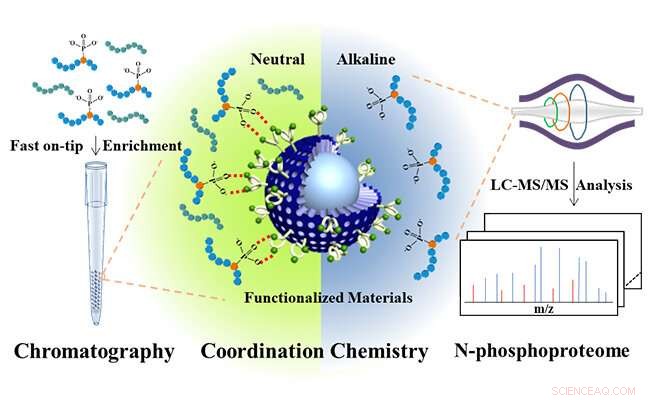
Inspirado por fosfatases naturais, que fornecem bolsas enzimáticas centrais de Zn (II) específicas para ligar unidades de fosfato de substratos, os pesquisadores projetaram o bis (zinco (II) -dipicolilamina) molecular (DpaZn) para o reconhecimento de alvos de fosfato em condições neutras.
Combinando a capacidade de transferência rápida de massa de microesferas de sílica núcleo-casca sub-2 μm, Microesferas de sílica núcleo-shell funcionalizadas com DpaZn sub-2 μm (SiO 2 @DpaZn) foram projetados para enriquecimento de N-fosfopeptídeos na ponta sob condições neutras. No total, 3, 384 sites N-pho, contendo 611 pHis, 1618 pLys e 1155 pArg, foram identificados a partir de lisados de células HeLa.
O novo método de análise de proteoma N-fosforilado fornece não apenas dados básicos para um estudo aprofundado de sua função biológica, mas também suporte técnico para promover o desenvolvimento da medicina de precisão, biologia sintética e outros campos.