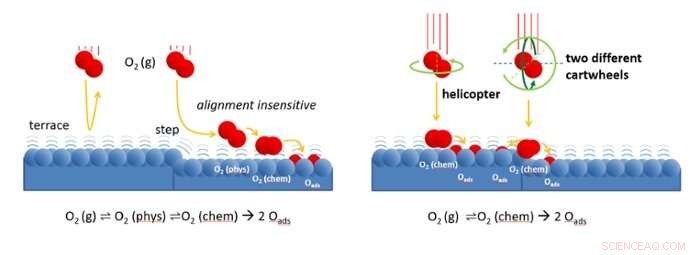
Figura à esquerda:As moléculas de oxigênio se aproximam da superfície do catalisador com baixa velocidade. As etapas na superfície espalham as moléculas em um estado "fisisorvido" fracamente ligado. De lá, as moléculas podem facilmente encontrar seu caminho para um local onde se ligam quimicamente e, finalmente, se dissociam. Nos terraços atomicamente planos, espalhar de volta para a fase gasosa é muito mais provável. Como o estado fisisorvido é fracamente ligado, assemelha-se fortemente à molécula na fase gasosa. Em ambos, a molécula pode girar. O processo de espalhamento, portanto, não depende do alinhamento inicial da molécula. Figura à direita:em alta velocidade incidente, O O2 pode ser adsorvido diretamente em um estado quimicamente ligado. Em terraços, moléculas que o helicóptero tem uma chance maior de se ligar do que aquelas que fazem "carthweel". Apenas em etapas, moléculas girando são sensíveis ao alinhamento. Moléculas que giram ao longo da borda dos degraus (rotação verde-escuro) aderem mais facilmente à borda do que aquelas que giram contra a borda (rotação verde claro). Crédito:Universidade de Leiden
Platina é um catalisador amplamente utilizado, mas seu mecanismo preciso permanece em grande parte um mistério para os cientistas. Ludo Juurlink demonstrou pela primeira vez como o oxigênio reage na superfície da platina. Juntamente com o Ph.D. alunos Kun Cao e Richard van Lent e colegas internacionais, ele publicou suas descobertas em PNAS .
No início deste ano, Juurlink resolveu um problema de química de 40 anos, junto com Richard van Lent e o instituto DIFFER. Usando uma superfície curva única de platina, ele provou como o hidrogênio reage na platina. Em sua pesquisa atual, ele novamente usou a platina curva, desta vez investigando a reação com o oxigênio.
Isso levou a uma descoberta interessante. Juurlink e colegas observaram que o oxigênio reage na platina de uma maneira diferente do hidrogênio, muito mais leve. A platina curva foi novamente crucial para esta descoberta. "Como a superfície da platina é curva, a estrutura atômica muda muito gradualmente ao longo da superfície, "explica Juurlink. Essa estrutura pode ser comparada a uma escada com degraus que se estreitam cada vez mais em direção às bordas. No meio, a superfície parece mais um salão de baile. "
A reatividade do hidrogênio acabou dependendo da proximidade das etapas do catalisador. Este também é o caso do oxigênio, mas por uma razão fundamentalmente diferente. "As etapas têm um efeito diferente no oxigênio e no hidrogênio."
De acordo com Juurlink, isso tem a ver principalmente com a massa maior de oxigênio. "Porque o oxigênio é mais pesado que o hidrogênio, a interação com a superfície da platina começa de uma distância maior, "diz ele." A molécula de oxigênio já sente a interação com a platina, mas ainda não pode ver os detalhes. Como resultado, a reação ocorre de uma maneira diferente daquela com o hidrogênio. "
Para o experimento, era necessário controlar a direção de rotação das moléculas de oxigênio. Isso exigia cooperação com um colega japonês, Mitsunori Kurahashi, que construiu um dispositivo único para este propósito. "Ano passado, Tive a oportunidade de realizar medições em seu laboratório por duas semanas com uma bolsa do instituto onde Kurahashi trabalha, "diz Juurlink.
"Esta é uma bela descoberta fundamental, conclui Juurlink, que também pode ter um impacto sobre os aplicativos existentes. A reação do oxigênio à platina é essencial no setor de energia sustentável e na melhoria da qualidade do ar. "Por exemplo, a reação ocorre em células de combustível de hidrogênio e em sistemas de escapamento de automóveis, "diz o químico." O fato de agora podermos medir como a reação ocorre em um nível tão detalhado, impõe desafios aos modelos teóricos que descrevem essa reação química e fazem previsões sobre ela. "