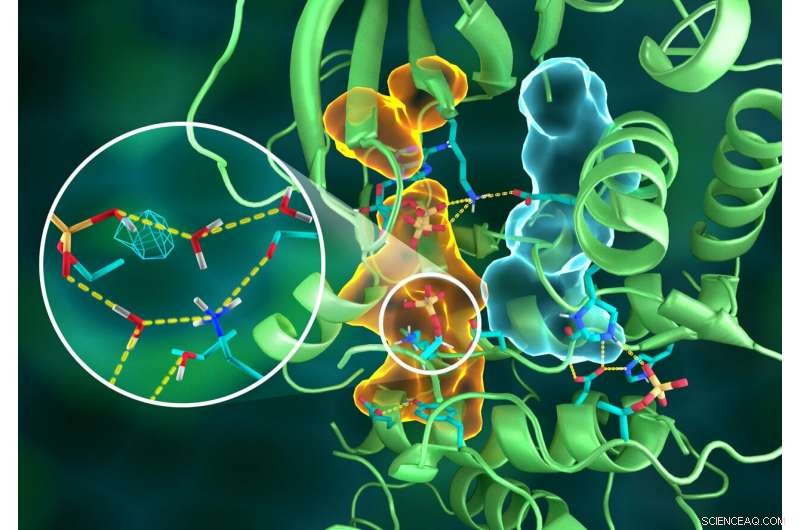
Ilustração da intrincada organização da estrutura PKA, em que diferentes partes da proteína são conectadas por meio de elaboradas redes de ligações de hidrogênio (linhas amarelas tracejadas), colados pelos conjuntos hidrofóbicos (volumes em azul claro e laranja) - todos trabalhando juntos para construir o local ativo funcional. A inserção mostra a protonação do grupo fosforil transferido (malha ciano) e suas muitas interações com a água e os resíduos de aminoácidos do sítio ativo. Crédito:ORNL / Jill Hemman
As observações diretas da estrutura e do mecanismo catalítico de uma enzima quinase prototípica - proteína quinase A ou PKA - fornecerão aos pesquisadores e desenvolvedores de drogas habilidades significativamente aprimoradas para compreender e tratar doenças fatais e distúrbios neurológicos, como câncer, diabetes, e fibrose cística.
A descoberta foi feita por uma equipe internacional de pesquisadores usando cristalografia macromolecular de nêutrons no Laboratório Nacional de Oak Ridge do Departamento de Energia e no Institut Laue-Langevin em Grenoble, França. Com base em uma investigação de uma década, os esforços combinados revelaram características anteriormente desconhecidas da proteína quinase arquetípica, incluindo um mapa completo da estrutura atômica e as bases da química da enzima usada na sinalização celular. Os detalhes são publicados na revista Avanços da Ciência .
As quinases são um grande grupo de centenas de enzimas responsáveis por iniciar e regular uma miríade de processos celulares. As quinases enviam sinais às proteínas por meio da fosforilação - adicionando um grupo químico reativo que consiste em fósforo e oxigênio a um local específico em uma proteína substrato para ativar sua função biológica específica.
Os problemas surgem quando as mutações genéticas fazem com que as quinases funcionem de forma inadequada, o que, por sua vez, leva à doença. Uma quinase com defeito, ou um que não pode ser desativado, pode ser responsável pela superexpressão de proteínas que levam à propagação incontrolável de células cancerosas. O oposto também é verdadeiro em distúrbios neurológicos nos quais uma quinase com defeito simplesmente faz com que as células morram.
"Criar drogas que tenham como alvo cinases específicas é extremamente importante, "disse o co-autor Andrey Kovalevsky." Este entendimento detalhado da estrutura PKA e sua dinâmica vai nos dizer mais sobre outros tipos de quinases e deve ajudar os desenvolvedores de medicamentos a projetar novos medicamentos com melhor especificidade, o que acabaria por se traduzir em uma terapêutica mais precisa com menos efeitos colaterais ”.
Mudanças na estrutura da proteína devido a mutações podem ser difíceis de detectar, embora os efeitos das mutações no comportamento dinâmico da proteína possam ser bastante profundos. Contudo, esses comportamentos dinâmicos tornam-se mais aparentes ao examinar a rede geral de ligações de hidrogênio em toda a proteína.
Os nêutrons são especialmente sensíveis aos elementos leves, como o hidrogênio. Como aproximadamente 50 por cento de todos os átomos nas proteínas são hidrogênio, e a maioria das reações químicas que as enzimas catalisam envolvem hidrogênio, nêutrons são uma sonda ideal e insuperável para detectar as posições dos átomos de hidrogênio dentro da estrutura da proteína e rastrear seu movimento durante a catálise.
Difração de nêutrons usando o difratômetro IMAGINE no reator de isótopos de alto fluxo de ORNL, um DOE Office of Science User Facility, e o difratômetro LADI-III no ILL permitiu aos pesquisadores ver as posições exatas dos átomos de hidrogênio para revelar a estrutura completa da quinase, bem como os estados de protonação de todos os aminoácidos em PKA e os ligantes ligados ao seu sítio ativo, muitos dos quais eram previamente desconhecidos.
"Os nêutrons nos permitiram validar as previsões de raios-X das posições dos átomos de hidrogênio, bem como determinar os estados de protonação de grupos químicos que não eram conhecidos, ou em lugares onde não esperávamos encontrá-los. Este grande avanço químico abre caminho para modelagem molecular mais sofisticada e estudos de simulação da estrutura e função da proteína quinase, "disse a autora correspondente, Susan Taylor.
"Os nêutrons oferecem uma visão sem precedentes da rede de ligações de hidrogênio ao redor e dentro do sítio ativo de PKA e fornecem informações cruciais sobre como ocorre a transmissão alostérica de informações através da estrutura da proteína, "acrescentou o co-autor Gianluigi Veglia." A combinação da cristalografia de nêutrons com a espectroscopia de ressonância magnética nuclear fornecerá uma compreensão abrangente de como as enzimas funcionam. "