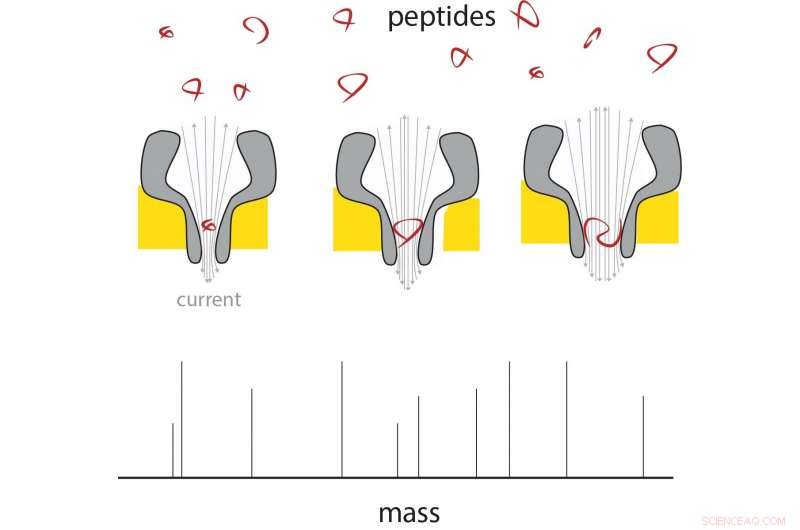
Um peptídeo entra na extremidade fina do nanopore, e lá muda a corrente em proporção à sua massa. Usando nanoporos de tamanhos diferentes, uma gama de tamanhos de peptídeo pode ser medida. Crédito:G. Maglia / Universidade de Groningen
Cientistas da Universidade de Groningen desenvolveram nanoporos para medir diretamente a massa dos peptídeos. Embora a resolução precise de melhorias, esta prova de princípio mostra que um espectrômetro de massa de peptídeo barato e portátil pode ser construído usando a tecnologia nanopore existente e os poros patenteados que foram desenvolvidos no laboratório do Professor Associado de Biologia Química da Universidade de Groningen, Giovanni Maglia. Um artigo sobre esta descoberta foi publicado em Nature Communications em 19 de fevereiro.
Os espectrômetros de massa são inestimáveis para estudar proteínas, mas são volumosos e caros, o que limita a sua utilização a laboratórios especializados. "Ainda, a próxima revolução nos estudos biomédicos será na proteômica, a análise em grande escala de proteínas que são expressas em diferentes tipos de células, "diz Maglia. Embora cada célula do seu corpo carregue o mesmo DNA, a produção de proteínas difere enormemente entre os tipos de células. "E também, proteínas são modificadas após terem sido produzidas, por exemplo, adicionando açúcares que podem afetar sua função. "
Massa
A tecnologia nanopore pode oferecer uma maneira de analisar moléculas individuais. Em trabalhos anteriores, Maglia já mostrou que os nanoporos biológicos podem ser usados para medir metabólitos e identificar proteínas e peptídeos. Esses poros são grandes estruturas de proteínas, incorporado em uma membrana. As moléculas que entram ou passam por um poro causam uma mudança na corrente elétrica através do poro. "Um problema na medição da massa de peptídeos é que eles passam muito rapidamente até mesmo pelo menor poro biológico para obter uma leitura, "explica Maglia.
Fazer poros menores foi um desafio. "Os poros são compostos de uma série de monômeros, então, inicialmente modificamos a interação entre esses monômeros, mas isso não funcionou. "A observação de que a mistura de monômeros com maiores quantidades de lipídios - que compõem a membrana - resultou em uma porcentagem maior de poros menores deu a Maglia e sua equipe a ideia de modificar a interação entre monômeros e lipídios. na verdade resultou em poros compostos por um número menor de monômeros, que reduziu o tamanho dos poros.
Os menores poros de todos os tempos
Maglia foi então capaz de produzir poros em forma de funil que, em sua extremidade estreita, mediu apenas 0,84 nanômetros. "Esses são os menores poros biológicos já produzidos." O próximo desafio era garantir que os peptídeos passassem pelos poros, independentemente da sua composição química. "Os poros têm carga negativa, que é necessário para o seu funcionamento adequado, "explica Maglia.
A carga faz com que a água flua através do poro, arrastando os peptídeos junto. Mas os peptídeos com carga negativa seriam repelidos pela carga negativa na extremidade do funil fino. Maglia modificou a carga alterando a acidez dos fluidos usados. "Eventualmente, conseguimos encontrar as condições adequadas ajustando a acidez a um pH de exatamente 3,8. Isso permite que os peptídeos carregados negativamente passem, enquanto mantém um fluxo de água grande o suficiente através dos poros. "
Resolução
Medições em nanoporos de tamanhos diferentes mostram que a corrente elétrica é linear com o volume do peptídeo que o atravessa. Esses peptídeos variaram de 4 a 22 aminoácidos de comprimento. A diferença entre os aminoácidos alanina e glutamato pode ser medida neste sistema, o que significa que a resolução está em torno de 40 Dalton (uma medida para a massa da proteína). "A resolução dos espectrômetros de massa convencionais é muito melhor, mas se pudéssemos deixar o sistema cerca de quarenta vezes mais sensível, já seria útil na pesquisa de proteômica, "diz Maglia. Existem várias maneiras de melhorar a resolução, diz Maglia. "Poderíamos projetar o nanopore com aminoácidos artificiais, ou usar íons diferentes em nossas soluções, reduza o ruído alterando a temperatura, etc. "
O sistema nanopore tem vários pontos de venda exclusivos:mede moléculas individuais, a tecnologia em si já está disponível comercialmente e é relativamente barata. Além disso, o sistema nanopore é portátil. E, usando muitos poros diferentes em um dispositivo, você pode medir simultaneamente peptídeos de tamanhos diferentes e até mesmo modificações de peptídeos. "Tudo isso significa que um espectrômetro de massa versátil e barato para análise de peptídeos é viável, "diz Maglia." E isso significaria que mais laboratórios seriam capazes de conduzir estudos de proteômica muito importantes. "