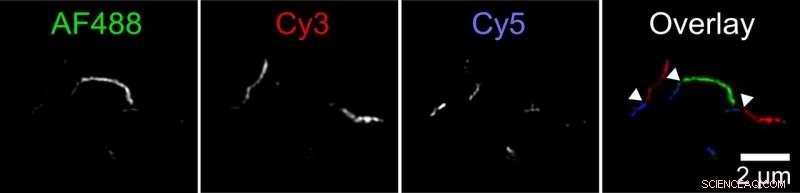
Os biofísicos descobriram um novo mecanismo pelo qual agregados de proteína tau, chamadas fibrilas, pode crescer. Duas fibrilas podem se prender de ponta a ponta. Esta figura mostra uma fibrila composta de fibrilas menores rotuladas em três cores. O pesquisador rotulou as proteínas tau com três corantes fluorescentes diferentes e permitiu que elas se agregassem em tubos de ensaio separados. Em seguida, ela misturou essas fibrilas de cores diferentes em um quarto tubo de ensaio. Imagens tiradas com um microscópio de fluorescência de super-resolução mostraram fibrilas longas com seções curtas de cada cor, indicando que as fibrilas dos tubos de ensaio originais devem ter extremidades unidas para formar fibrilas mais longas. Crédito:Carol Huseby / Ohio State University
No início do curso da doença de Alzheimer - muito antes que futuros pacientes comecem a notar os sintomas - emaranhados neurofibrilares compostos de agregados de proteína tau começam a se formar em suas células cerebrais. O quão tóxicos esses agregados são e quão bem eles se espalham dependem de seu tamanho. Contudo, cientistas que estudam a formação de emaranhados não foram capazes de explicar por que tamanhos diferentes de agregados de tau semelhantes a cabos aparecem em doenças.
Mas agora, pesquisadores da Ohio State University descobriram que, em vez de adicionar apenas uma proteína de cada vez, fibrilas de vários comprimentos podem se juntar de ponta a ponta para criar um filamento mais longo. A descoberta, que aparecerá no Journal of Biological Chemistry na segunda-feira, ajuda a explicar como as fibrilas podem crescer até centenas de nanômetros e também pode ajudar os pesquisadores a entender os mecanismos de um grupo emergente de candidatos a medicamentos projetados para inibir a agregação de tau.
Os cientistas podem usar modelos matemáticos para descrever processos biológicos, como a formação de fibrilas. Um modelo simples comum de agregação de tau inclui duas etapas. Na primeira etapa, duas proteínas tau se ligam lentamente, e, na segunda etapa, moléculas adicionais de tau se ligam rapidamente.
Primeira autora Carol Huseby, um estudante de graduação no laboratório de Jeff Kuret, trabalhando em colaboração com Ralf Bundschuh, se propôs a expandir este modelo matemático para incluir outras maneiras conhecidas como as fibrilas de tau se comportam. Os cientistas observaram, por exemplo, que às vezes uma fibrila se fragmenta em duas. Outros tempos, uma nova fibrila pode nuclear no meio de uma fibrila existente.
O modelo simples de duas etapas previu que um tubo de ensaio cheio de proteína tau purificada resultaria em um grande número de fibrilas curtas. Mas Huseby sabia que, quando os pesquisadores olham para a proteína tau agregada em um microscópio, eles veem um número menor de fibrilas longas. Essa discrepância sugeria que algo estava acontecendo no mundo real que não havia sido contabilizado no modelo. Eles levantaram a hipótese de que talvez as fibrilas curtas pudessem se anexar de ponta a ponta para ficar mais tempo.
Huseby fez uma série de experimentos para testar a hipótese. Em um, primeiro, ela rotulou as proteínas tau com três cores fluorescentes diferentes e permitiu que elas se agregassem em tubos de ensaio separados. Em seguida, ela misturou essas fibrilas de cores diferentes em um quarto tubo de ensaio.
Imagens tiradas com um microscópio de fluorescência de super-resolução mostraram fibrilas longas com seções curtas de cada cor, indicando que as fibrilas dos tubos de ensaio originais devem ter extremidades unidas para formar fibrilas mais longas. Experimentos de controle estabeleceram que isso não pode ser explicado pela preferência das moléculas rotuladas por rótulos semelhantes.
Depois que Huseby incorporou este novo mecanismo ao modelo, produziu uma descrição muito melhor do que as proteínas tau purificadas estavam realmente fazendo ao formarem agregados. Este estudo é o primeiro a mostrar que as fibrilas podem se alongar em mais de uma única proteína tau por vez.
Os pesquisadores de Alzheimer ainda estão tentando discernir se as fibrilas de tau são uma causa ou simplesmente um efeito da doença. Uma possibilidade é que a transmissão de fibrilas de uma célula para outra possa contribuir para a propagação de doenças no cérebro. Uma fibrila muito longa, de acordo com Kuret, é improvável que se espalhe dessa forma. "Mas uma vez que é quebrado em pequenos pedaços, aqueles podem se difundir, facilitando seu movimento de célula em célula. "
Este estudo usou apenas um tipo de tau. Seis isoformas de diferentes comprimentos são conhecidas, e a fosforilação e outras alterações aumentam a complexidade da proteína. Os pesquisadores planejam incorporar essas variáveis em trabalhos futuros, e começar a usar o modelo para entender como os inibidores de tau mudam o comportamento dos agregados de proteína.