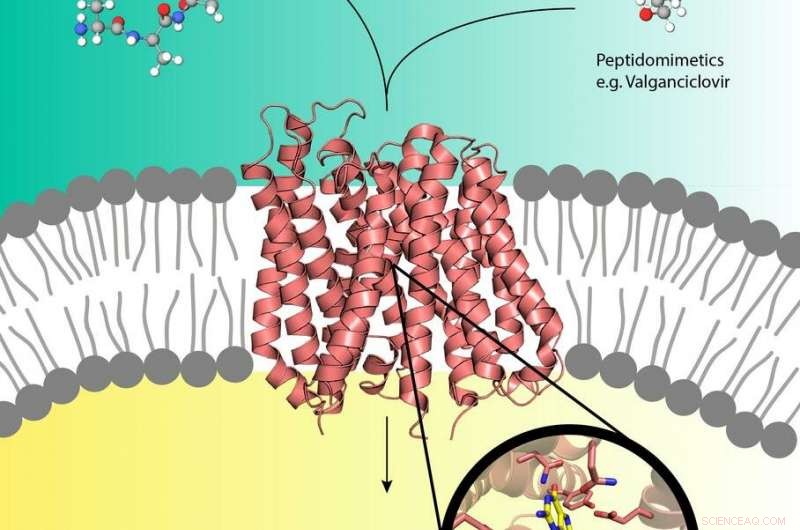
Pró-drogas como o Valganciclovir (canto superior direito) podem usar o transportador de peptídeo (centro) na membrana celular que geralmente transporta peptídeos nutrientes (canto superior esquerdo) para dentro da célula. Crédito:EMBL, Yonca Ural-Blimke
Experimentos na fonte de raios-X de DESY, PETRA III, revelaram a primeira estrutura de uma proteína transportadora biológica carregada com um pró-fármaco. Pró-drogas são medicamentos inativos que são metabolizados em um ativo, forma funcional dentro do corpo. Eles podem sequestrar as proteínas transportadoras de nutrientes humanos PepT1 ou PepT2 que estão localizadas na membrana celular e geralmente canalizam peptídeos derivados de alimentos digeridos para as células. Por aqui, pró-drogas podem pegar uma carona diretamente na célula, acelerando a absorção da droga. Embora o conceito pró-drogas seja muito eficaz, pouco se sabe a nível molecular sobre a estrutura dos transportadores de peptídeos e como eles reconhecem, ligar e transportar pró-drogas. Os grupos de Christian Loew e Jan Kosinski do Laboratório Europeu de Biologia Molecular (EMBL) que trabalham no Centro de Biologia de Sistemas Estruturais (CSSB) no campus do DESY em Hamburgo estão agora um passo mais perto de compreender isso.
Os cientistas determinaram a primeira estrutura cristalina de alta resolução de um transportador de peptídeo em complexo com o pró-fármaco valganciclovir farmacológico relevante; um medicamento que combate certas infecções virais. Seus resultados, publicado no Jornal da American Chemical Society , poderia ajudar na concepção de pró-drogas com taxas de absorção melhoradas. CSSB é uma cooperação de dez instituições científicas, incluindo DESY.
O transportador de peptídeo bacteriano DtpA de Escherichia coli é um homólogo próximo do transportador PepT1 humano e, portanto, foi escolhido pelos cientistas como um protótipo. A estrutura espacial de uma biomolécula pode ser determinada cultivando minúsculos cristais de muitas das mesmas biomoléculas e iluminando-as com raios-X. Os cristais difratam os raios X de uma forma que está relacionada à sua estrutura interna. Isso significa, do padrão de difração, a estrutura interna do cristal pode ser calculada, revelando a estrutura atômica de seus constituintes, as biomoléculas.
O cultivo de cristais de alta qualidade a partir de biomoléculas pode ser muito desafiador. Para produzir cristais de boa difração de DtpA, Loew se juntou ao grupo de Jan Steyaert da Vrije Universiteit em Bruxelas para gerar nanocorpos específicos DtpA. Os nanocorpos são fragmentos específicos de anticorpos de domínio único. "Eles aumentam a estabilidade de proteínas de membranas, como DtpA, permitindo-nos gerar cristais de alta qualidade, "explica Loew.
O grupo Loew realizou então os experimentos de cristalização de DtpA em complexo com um nanocorpo e uma molécula de pró-droga na instalação de preparação e caracterização de amostras (SPC) e analisou os cristais obtidos nas linhas de luz P13 e P14 que fazem parte do X- de DESY fonte de luz de raio PETRA III e operado por t EMBL. Os cientistas foram capazes de determinar uma estrutura de resolução de 2,65 Ångstrom (0,265 nanômetro) do DtpA ligado ao valganciclovir pró-droga que revelou um modo de ligação inesperado. "A orientação da pró-droga na bolsa de ligação é invertida em 180 graus em relação às previsões anteriores, "explica Loew." Nós também descobrimos que DtpA preferencialmente se liga e provavelmente transporta tripeptídeos sobre dipeptídeos. "
O grupo Kosinski construiu um modelo estrutural de alta qualidade do transportador PepT1 humano em complexo com valganciclovir usando a estrutura de cristal DtpA como guia. "O modelo mostra que o PepT1 humano muito provavelmente se liga à droga da mesma maneira que DtpA e identifica os grupos de aminoácidos exatos responsáveis pela ligação, "esclarece Kosinski. Portanto, os insights gerados por este modelo de PepT1 podem facilitar o desenvolvimento de novos pró-drogas com taxas de absorção melhoradas. Essas melhorias não apenas reduziriam a dose farmacologicamente eficaz, mas também reduziriam os efeitos colaterais negativos experimentados pelos pacientes.