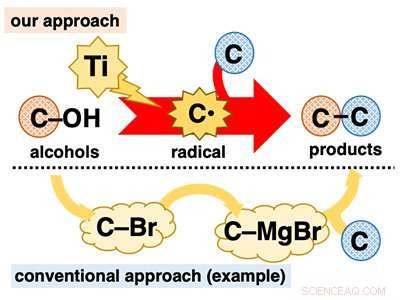
Uso direto de álcoois para reações de formação de ligações C-C. Crédito:Kanazawa University
Os álcoois desempenham um papel fundamental na síntese orgânica porque são onipresentes e podem ser usados em uma variedade de transformações bem estabelecidas. Contudo, em reações de formação de ligação C-C, apesar de ser central para a síntese orgânica, os álcoois são empregados principalmente de forma indireta. Muitas reações à base de álcool necessitam de pré-transformação tediosa do grupo hidroxi (C-OH) para outros grupos funcionais, como halogênios (por exemplo, C-Br) antes da formação da ligação C-C (Figura 1).
O desenvolvimento de reações de formação de ligação C-C de uma etapa usando álcoois é altamente desejável porque realiza a aplicação de materiais ubíquos sem a carga de um procedimento de várias etapas. Uma maneira de atingir esse objetivo é converter diretamente os álcoois em intermediários reativos conhecidos que instantaneamente sofrem reações de formação de ligações C-C. Imaginamos que poderíamos conseguir isso usando reagentes de titânio de baixa valência. O titânio de baixa valência é um redutor de um elétron e uma espécie altamente oxofílica. Por causa desses recursos, espera-se que o titânio de baixa valência possa extrair um átomo de oxigênio do álcool, clivar a ligação C-O em uma redução de um elétron para gerar o radical de carbono correspondente (C *). O radical de carbono é um intermediário extremamente reativo que prontamente sofre diversas reações, incluindo a formação da ligação C-C.
Resultados
O tratamento de 2-naftalenometanol com um reagente de titânio de baixa valência proporcionou uma mistura de dois produtos clivados C-O de hidrogenação e dimerização (Figura 2). Essas reações em si não foram muito úteis; Contudo, ambos eram evidências da geração de espécies de radicais benzila. Com este resultado preliminar, esperávamos que a adição de agentes de captura de radicais proporcionaria os produtos de acoplamento entre o radical benzil e os agentes de captura, interrompendo as reações de hidrogenação e dimerização. De fato, a adição de acrilonitrila como agente de captura deu o produto de acoplamento entre o radical benzila e acrilonitrila como o produto predominante.
O melhor resultado foi obtido quando o reagente de titânio de baixa valência foi preparado a partir de TiCl4 (colidina) e pó de manganês. Esta reação de formação de ligação C-C direta à base de álcool foi aplicada com sucesso a uma série de derivados de álcool benzílico. Notavelmente, ambos os álcoois benzílicos com substituintes doadores e retirantes de elétrons no anel aromático foram adequados para esta reação. Além disso, além de álcoois primários, álcoois secundários e terciários também foram adequados, apesar do aumento considerável na impedância estérica. Vários alcenos deficientes em elétrons, além do acrilonitrila, também foram bons reagentes. Com relação à praticidade, esta reação é econômica e fácil de conduzir, pelo menos em escala de laboratório. TiCl 4 (colidina) é estável durante o armazenamento, tolerante a uma breve exposição ao ar, e custa apenas aproximadamente 10 JPY / mmol.
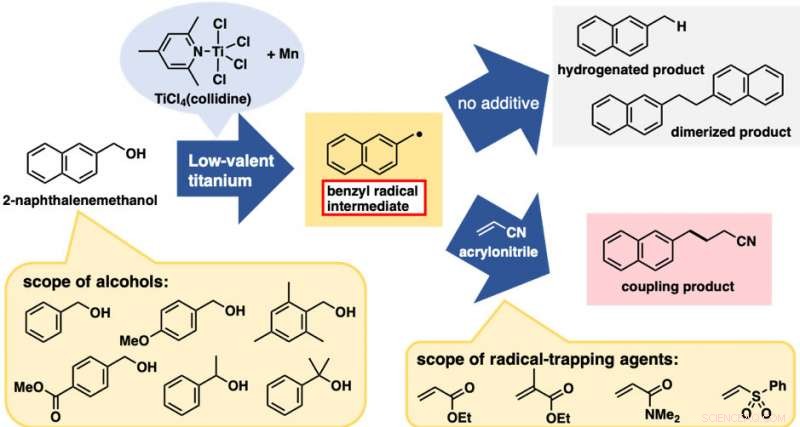
Reações de formação de ligações C-C de radicais diretos à base de álcool. Seta superior:reações sem agente de aprisionamento. Seta inferior:reações com agentes de captura de radicais (alcenos deficientes em elétrons). Crédito:Kanazawa University
Significância e perspectivas futuras
O significado deste método é que ele permite o uso direto de álcoois como equivalentes de radicais de carbono. Associamos os álcoois onipresentes ao conhecimento acumulado sobre as reações radicais. Acreditamos que este trabalho levará a pesquisas sobre outras reações radicais à base de álcool em um futuro próximo.