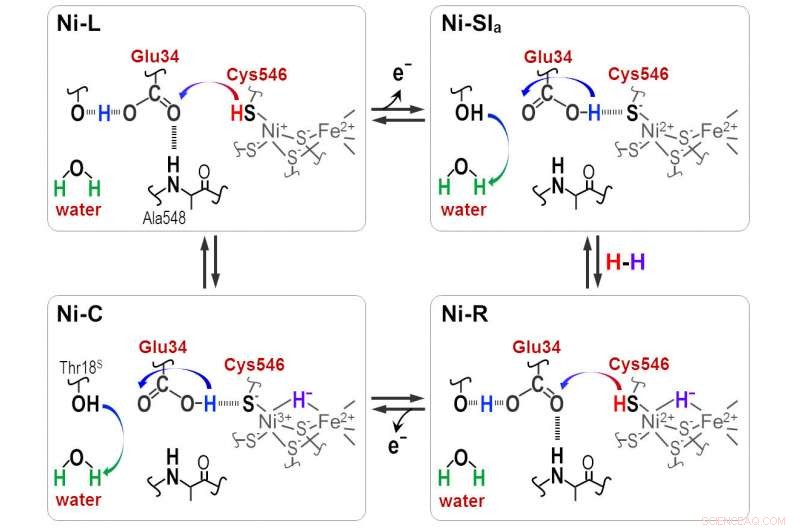
Os prótons são transferidos entre o sítio ativo do NiFe e a proteína ao redor dos resíduos Cyt546 e Glu34 durante a reação catalítica da [NiFe] hidrogenase. Crédito:Shun Hirota
Por todos os avanços que a tecnologia fez ao longo de nossas vidas, em muitos casos, está por trás do que a natureza pode fazer. As formigas podem carregar 5.000 vezes seu peso, e as teias de aranha são cinco vezes mais fortes que o aço. A eficiência do combustível não é diferente. Em um novo garanhão em Angewandte Chemie International Edition , pesquisadores do Instituto de Ciência e Tecnologia de Nara (NAIST) relatam novos detalhes sobre a via de transferência de prótons da níquel-ferro [NiFe] -hidrogenase usando espectroscopia de infravermelho com transformada de Fourier (FTIR). Esta transferência é crucial para o metabolismo do hidrogênio dos microrganismos, e o estudo dá aos cientistas uma melhor compreensão de como imitar a natureza na construção de novas células de biocombustível.
O metabolismo do hidrogênio é uma das formas mais antigas de produção de energia para a vida e uma das mais intensamente estudadas por causa de sua importância na evolução. Também chamou a atenção por ser uma fonte de energia limpa. Entre as enzimas responsáveis pelo metabolismo do hidrogênio, A [NiFe] -hidrogenase é a mais abundante e antiga.
Muito se sabe sobre a enzima. Ele oxidases reversivelmente átomos de hidrogênio por meio de seu sítio ativo de Ni-Fe, que é rodeado por aminoácidos específicos. Contudo, observa o professor do NAIST Shun Hirota, quem gerenciou o estudo, certos fundamentos nas reações químicas precisam ser compreendidos antes de usar esta nanomáquina para projetar tecnologias de biocombustíveis.
"Hidreto e próton coordenam-se com o sítio Ni-Fe no ciclo de protonação-desprotonação, resultando em quatro estados de hidrogenase. Mas a via de transferência de prótons permanece desconhecida, " ele diz.
Uma razão para a falta de clareza tem sido a incapacidade de resolver as frequências de alongamento de diferentes ligações de hidrogênio. No novo trabalho, Equipe do Hirota, em colaboração com outros pesquisadores no Japão e na China, resolveu este problema observando fotoconversões de três estados de hidrogenase com espectros de FTIR.
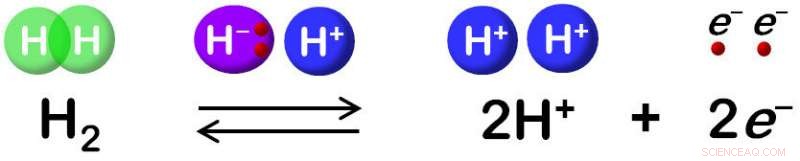
A hidrogenase catalisa a oxidação reversível de H2. Crédito:Shun Hirota
Frequências de absorbância distintas revelaram que uma das quatro cisteínas, cisteína 546, junto com outro aminoácido, ácido glutâmico 34, e uma molécula de água ordenada são cruciais para a transferência. Os cientistas usaram as novas informações para deduzir como a molécula de enxofre da cisteína 546 e o grupo ácido do ácido glutâmico 34 formam ligações de hidrogênio para regular o transporte de hidrogênio.
"Nossos resultados mostram que a cisteína 546 é um doador e aceitador de prótons no ciclo da hidrogenase [Ni-Fe]. Eles também demonstram como uma ligação de hidrogênio de baixa barreira para o ácido glutâmico 34 é formada e clivada durante o ciclo catalítico, "nota Hirota.
Os microrganismos se adaptaram a uma ampla gama de condições ambientais do que os humanos. Eles podem ser encontrados no clima confortável de nossos quartos para os ambientes mais hostis do planeta. Assim, ver como o local [Ni-Fe] da [Ni-Fe] hidrogenase transfere prótons de forma otimizada fornece um paradigma para pesquisadores que buscam fabricar catalisadores de energia de alta eficiência sob uma série de condições.
“A vida passou bilhões de anos se adaptando à energia. Acreditamos que ela nos dá o melhor modelo de eficiência energética no futuro, "diz Hirota.