Crédito:Wiley
Algumas pequenas células diferentes das demais podem ter um grande efeito. Por exemplo, células cancerosas individuais podem ser resistentes a uma quimioterapia específica - causando uma recaída em um paciente que, de outra forma, estaria curado. No jornal Angewandte Chemie , cientistas agora introduziram um chip baseado em microfluídica para a manipulação e subsequente análise de ácido nucléico de células individuais. A técnica usa campos elétricos locais para "prender" as células de forma altamente eficiente (dieletroforese).
As análises moleculares de células individuais são necessárias para compreender melhor o papel das populações de células heterogêneas no desenvolvimento de doenças e para desenvolver terapias eficazes para a medicina personalizada. Identificar células individuais em uma massa de outras células é um enorme desafio na medicina diagnóstica. As células devem ser classificadas, guardado, transferido para outro recipiente com um volume extremamente pequeno ( <1 μL) e, em seguida, deve ser submetido a uma análise molecular. Os métodos convencionais são geralmente muito demorados e complexos, bem como não confiável e ineficiente. Eles também podem comprometer a viabilidade das células, requerem grandes volumes de amostra, têm um alto risco de contaminação, e / ou requerem instrumentos caros.
Cientistas da Universidade de Washington (Seattle, EUA), Iowa State University (Ames, EUA), e Fred Hutchinson Cancer Research Center (Seattle, EUA) usaram tecnologia microfluídica para superar esses problemas. Todas as etapas necessárias ocorrem de forma confiável em um microchip especialmente desenvolvido, usando quantidades mínimas de solvente e sem exigir que as células sejam marcadas. Em contraste com os chips microfluídicos convencionais, este não requer tecnologia de fabricação complexa nem componentes como válvulas ou agitadores.
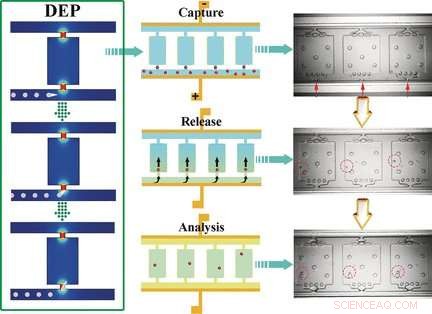
O chip dieletroforético de autodigitalização (SD-DEP) tem aproximadamente o tamanho de uma moeda e tem dois microcanais paralelos (50 μm de profundidade x 35 μm de largura x 3,2 cm de comprimento) conectados por numerosas câmaras minúsculas. As aberturas dos microcanais têm apenas 15 μm de largura. Um fino eletrodo é esticado ao longo do comprimento dos canais. Os canais e câmaras são preenchidos com um buffer, uma tensão alternada é aplicada, e a amostra é adicionada a um dos microcanais. A equipe chefiada por Robbyn K. Anand e Daniel T. Chiu usou células de leucemia em seus experimentos.
Máximos locais do campo elétrico ocorrem nas entradas estreitas das câmaras. As células que entram nas câmaras ficam "presas". Como as dimensões da entrada são semelhantes ao tamanho médio de uma célula, apenas uma única célula pode ser capturada por cada entrada da câmara. Quando a corrente alternada é desligada e a taxa de fluxo é aumentada pela injeção dos reagentes necessários para a análise subsequente, as células são lavadas para as câmaras. Um óleo é então adicionado para selar as câmaras. As células são então dissolvidas, e os ácidos nucléicos são liberados e multiplicados e podem ser identificados como células de leucemia por um gene marcador.
Em estudos futuros, os pesquisadores esperam usar o chip para determinar a distribuição de mutações genéticas que estão relacionadas à resistência em células de leucemia e, portanto, podem causar recaídas.