 p Crédito:Rice University
p Crédito:Rice University
p Cientistas da Rice University que dizem que os sensores biológicos não são sensíveis o suficiente estão fazendo algo a respeito. p O laboratório do biólogo sintético Jeffrey Tabor introduziu uma nova técnica para aumentar ou diminuir a sensibilidade dos sistemas de dois componentes - uma classe de proteínas que as bactérias usam para sentir uma ampla variedade de estímulos.
p A técnica pode permitir a engenharia de biossensores feitos sob medida para o diagnóstico de bactérias intestinais, detecção de poluentes ambientais ou controle automatizado dos níveis de nutrientes no solo.
p Sensores de dois componentes, o foco de um novo artigo que descreve o trabalho na Nature Communications, são uma grande família de sensores codificados geneticamente que as bactérias usam para detectar uma entrada específica e ativar um gene específico em resposta a mudanças em seu ambiente.
p Embora esses sensores sejam conhecidos há três décadas, eles não eram sensíveis o suficiente para Tabor. Ele, o ex-aluno de Rice e o autor principal Brian Landry decidiram diminuir a quantidade de informações necessárias para ativá-los.
p Ao combinar modelagem computacional e experimentos, eles conseguiram exatamente isso. No papel, eles descrevem sua descoberta de que a atividade da fosfatase, que é essencial para a regulação e sinalização nas células, pode ter um efeito dramático nos limites de detecção de sistemas de dois componentes.
p Pesquisas anteriores haviam mostrado que mutações no primeiro componente, uma proteína de sensor de sinalização conhecida como histidina quinase, pode ser usado para controlar a extensão da fosforilação do segundo componente, uma proteína reguladora de resposta. Mas ninguém sugeriu que as mutações da fosfatase pudessem ser usadas para alterar a sensibilidade dessas vias para suas entradas, Disse Tabor.
p Um dia, diante de um sensor de nitrato que não ligava como esperado no intestino de um rato doente, Landry levantou a hipótese de que as mutações da fosfatase podem aumentar drasticamente a sensibilidade da via.
p Ele primeiro validou a hipótese usando um modelo matemático e depois conduziu experimentos que mostraram que as mutações aumentavam a eficiência de um sensor de nitrato por um fator de 100. O laboratório de Tabor validou a abordagem em sistemas de dois componentes que detectam uma ampla variedade de entradas , mesmo em espécies muito diferentes de bactérias.
p Landry trabalhou com outro estudante de bioengenharia de Rice, co-autor Lucas Hartsough, para identificar um aminoácido "ponto quente" presente em 64 por cento de todos os sensores de histidina quinases que podem sofrer mutação para ajustar a sensibilidade. Eles validaram a abordagem em duas vias minimamente caracterizadas, o que sugeriu que pode ser amplamente aplicado, Disse Tabor.
p Landry também usou a tecnologia para criar uma bactéria do solo, Bacillus subtilis, para sentir e responder a uma ampla gama de concentrações de nitrato (fertilizante) no solo. Tabor e Landry sugerem que este sistema pode ser acoplado a caminhos em desenvolvimento por um colega do MIT, o biólogo sintético Chris Voigt, e seu laboratório para desenvolver bactérias do solo que mantêm os níveis ideais de nitrogênio no solo sem a necessidade de fertilizantes.
p Os sistemas de dois componentes podem ser acionados por muitos tipos de entradas, incluindo gases, moléculas heme no sangue, açúcares, polissacarídeos intestinais, hormônios humanos ou vegetais ou mesmo luz.
p "É por isso que estamos tão animados com isso, - disse Tabor. - Todos esses sensores operam da mesma maneira. Todos eles têm a fosfatase e a quinase. Identificamos mais de 25, 000 deles em genomas bacterianos e acreditamos que nossa estratégia funcionará na maioria deles. "
p Ele disse que a técnica de seu laboratório depende da via de sinalização pela qual as moléculas sensoras naturais dizem às células para pararem, iniciar ou modificar a produção de proteínas. Ajustar sensores naturais para aplicações sintéticas tem sido difícil até agora, ele disse.
p "Uma das grandes limitações é que quando você tira um biossensor da natureza, pode sentir o produto químico em que você está interessado, mas não na concentração certa. Isso ocorre porque ele evoluiu para permitir que uma bactéria sobreviva melhor em um ambiente natural, em vez de satisfazer as necessidades de engenharia de um biólogo sintético, " ele disse.
p "Chamamos esse nível de limite de detecção do sensor, e não tem havido muitas tecnologias boas para ajustar esse limite para atender às nossas necessidades de engenharia, "Tabor disse." Essa tem sido uma grande limitação no projeto de biossensores. Mas agora, encontramos um truque geral que nos permite ajustar os limites de detecção desta família de sensores bacterianos de uma forma muito racional, e funciona muito bem. "
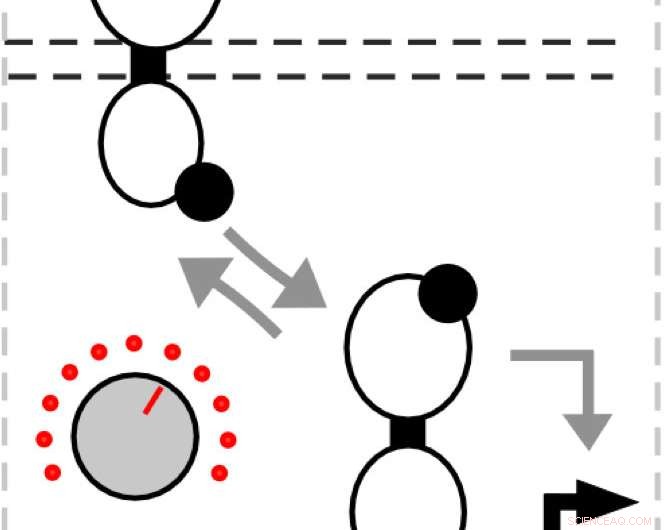
p Em suas simulações e experimentos, o laboratório alterou a proteína histidina quinase, que detecta uma entrada e libera um grupo fosfato que se liga ao regulador de resposta. Este, por sua vez, liga-se ao DNA para ativar a expressão do gene.
p "Quando você ativa a expressão gênica, esse é o seu sinal, "Tabor disse." O que é legal sobre esses caminhos é que, quando a entrada está ausente, o sensor histidina quinase atua como uma fosfatase e remove o grupo fosfato. Quando isso acontecer, o regulador da resposta sai do DNA e não ativa mais a expressão do gene. "
p Ele disse que a mutação da histidina quinase para favorecer a ativação ou desativação do sinal pode ser usada para controlar as ações dos reguladores de resposta, e, portanto, a quantidade de proteínas desejadas produzidas.
p "Concluímos que é como um cabo de guerra entre a atividade da quinase e a atividade da fosfatase, "Tabor disse." Esse equilíbrio determina quanta entrada é necessária para ligar o sensor. Portanto, é como um botão onde podemos tornar a atividade da fosfatase mais forte ou mais fraca para sintonizar a entrada. "
p Ele disse que a generalidade do processo deve impulsionar a biologia sintética em geral. "Existem métodos alternativos para fazer o que fizemos aqui, mas eles são muito mais intensivos em mão-de-obra, - disse Tabor. - É mais provável que falhem, e eles fariam todo um Ph.D. para fazê-los trabalhar, considerando que podemos fazer isso em uma semana e fazer funcionar. "
