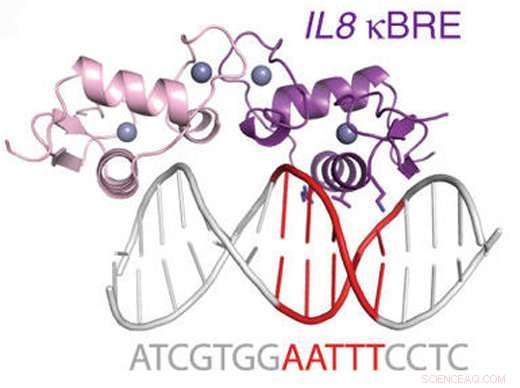
Figura:Diagrama do receptor de glicocorticóide ligando-se a um local NF-kappaB. Crédito:Hudson et al, Nature Communications (2018).
Drogas antiinflamatórias, como a dexametasona, podem ter efeitos colaterais prejudiciais na pele, ossos e metabolismo. A pesquisa em biologia estrutural da Emory University School of Medicine tem implicações para a longa busca de separar os benefícios dessas drogas de seus efeitos colaterais.
As descobertas foram publicadas recentemente em Nature Communications .
A dexametasona é um hormônio glicocorticóide sintético, usado para tratar doenças como alergias, asma, doenças autoimunes e câncer. Ele imita a ação do hormônio natural cortisol. Tanto o cortisol quanto os hormônios sintéticos atuam ligando-se à proteína do receptor de glicocorticóide (GR).
GR pode se ligar ao DNA de dois modos. Em alguns sites, ele se emparelha ou "dimeriza" - ativando os genes. Em outros, liga um de cada vez, desligando genes. Para drogas direcionadas a GR, acredita-se que os efeitos colaterais venham da ativação de genes envolvidos em processos como metabolismo e crescimento ósseo, enquanto os efeitos antiinflamatórios desejados resultam principalmente do desligamento dos genes do sistema imunológico e inflamatório.
Em seu novo jornal, Eric Ortlund, Ph.D., e colegas relatam que a capacidade do GR de se ligar diretamente ao DNA se estende de forma mais ampla do que anteriormente apreciado. O primeiro autor é Will Hudson, Ph.D., anteriormente um estudante de graduação com Ortlund e agora um pós-doutorado no laboratório de Rafi Ahmed no Emory Vaccine Center.
GR era conhecido por interferir com outra proteína importante de ligação ao DNA chamada NFkB, um regulador mestre da inflamação. A equipe de Ortlund descobriu que o GR pode se ligar diretamente um de cada vez a muitos dos mesmos trechos de DNA com os quais o NFkB interage.
“Este tipo de interação, onde GR está agindo um de cada vez - achamos que é drogável, "diz Ortlund, que é professor associado de bioquímica na Emory University School of Medicine.
Ele acrescenta que as descobertas do artigo podem levar à reinterpretação de vários estudos no campo da regulação de genes inflamatórios. GR foi proposto anteriormente para interagir com sites NFkB por "tethering, "com base nas interações proteína-proteína.
Ortlund observa que as mutações que interferem na capacidade do GR de dimerizar não afetam sua capacidade de diminuir a inflamação. Por outro lado, mutações que interrompem sua capacidade de se ligar ao DNA impedem suas funções de ativação e repressão.
Os pesquisadores mediram a afinidade entre a proteína GR e o DNA nos locais de ligação do NFkB e mostraram que era semelhante a outras interações dirigidas por hormônios pelas quais GR era bem conhecido. Eles também investigaram o modo de interação entre a proteína GR e os locais de ligação de NFkB, usando cristalografia de raios-X e RMN (ressonância magnética nuclear). Eles mostraram que o GR liga esses sites um de cada vez, em uma região que está realmente entre os dois trechos de DNA contatados pelo próprio NFkB.
Os mesmos tipos de interação estão acontecendo nas células? Hudson, Ortlund e colegas reanalisaram dados de outros para mostrar que a ligação direta ao DNA um por vez por GR pode ser responsável pela repressão de muitos genes de inflamação.