
Dr. Ohkanda mantém o composto estrategicamente projetado para se prender no orifício da enzima. Crédito:Junko Ohkanda Ph.D., Professor da Assembleia Acadêmica, Instituto de Agricultura, Shinshu University
"A estratégia era projetar a droga para ser capaz de enganchar no orifício da FTase e GGTase I, caso contrário, a superfície das proteínas é muito grande e escorregadia, "A Dra. Junko Ohkanda, da Shinshu University, explica sua estratégia por trás do artigo escolhido por Química - Um Jornal Europeu como um "Hot Paper".
As empresas farmacêuticas em todo o mundo vêm tentando criar um medicamento eficaz para atingir as proteínas K-Ras nos últimos 20 a 30 anos. Quando as proteínas K-Ras sofrem mutação, eles fazem com que o switch multiply permaneça perpetuamente ligado, tornando-se uma forma agressiva e intratável de câncer. Em 90 a 100% dos cânceres pulmonares e pancreáticos difíceis, Diz-se que K-Ras desempenha um papel. 30% de todos os cânceres apresentam alguma forma de mutação Ras.
Os cientistas tiveram problemas para projetar uma droga para se infiltrar no K-Ras devido à falta de bolsos interativos. Uma nova estratégia foi concebida para atacar o FTase, uma enzima importante na modificação lipídica do K-Ras. Sem FTase, o K-Ras mutado seria incapaz de se multiplicar incontrolavelmente. Os cientistas desenvolveram um grande número de inibidores da FTase, mas achou difícil inativar a modificação K-Ras.
Mesmo quando a FTase foi inibida, As modificações do K-Ras não foram interrompidas porque a GGTase I também estava reagindo com o K-Ras, apesar de sua cavidade reativa diferente. Não foi entendido porque, até que seu mecanismo foi elucidado que FTase e GGTase I são ambos feitos de duas partes de proteína, um dos quais é o mesmo, com exatamente o mesmo DNA.
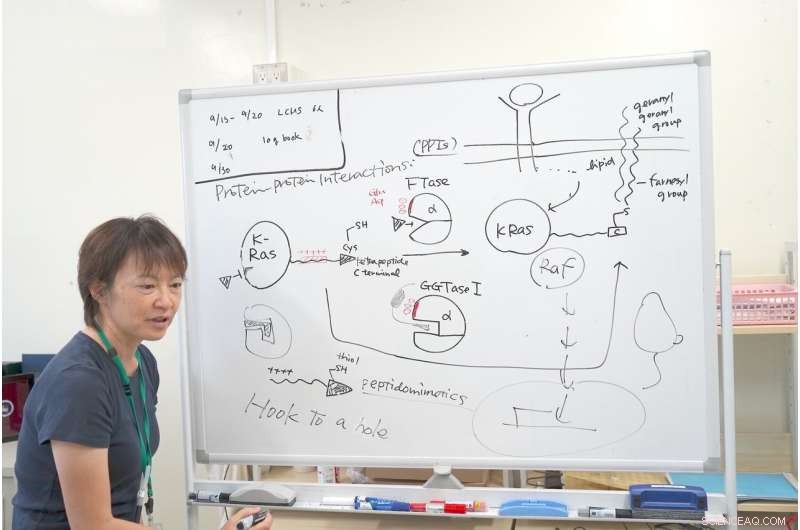
Dra. Ohkanda explica o mecanismo de sua pesquisa com K-Ras. Crédito:Junko Ohkanda Ph.D., Professor da Assembleia Acadêmica, Instituto de Agricultura, Shinshu University
Perto da cavidade ativada, FTase e GGTase I têm o mesmo grupo de aminoácidos ácidos, como ácido glutâmico e ácido aspártico, carregando uma carga negativa. Ao observar de perto o terminal C K-Ras, tinha uma carga positiva interativa. Outras proteínas Ras não têm essa área carregada positivamente. Apenas K-Ras tem esse conjunto de cargas positivas. É por isso que mesmo que a FTase fosse inibida, o K-Ras ainda reagiu com a GGTase I, embora sua cavidade fosse diferente.
Foi aqui que a Dra. Ohkanda teve seu momento de inspiração. Em teoria, a bolsa da enzima e a chave de cistina se ligam e se unem. Mas, neste caso, as superfícies das proteínas, com o mais e o menos também interagem. Mesmo que a FTase seja inibida, o K-Ras interagiu erroneamente com a GGTase I. A Dra. Ohkanda e seus colegas pensaram que com um composto eles poderiam exercer duas funções.
A estratégia foi projetar uma molécula que imitasse a parte do K-Ras que atua na bolsa ativa e também na superfície ácida. Nem é preciso dizer que a função da droga deve acontecer dentro da célula. Moléculas grandes que são úteis nas interações proteína-proteína costumam ser grandes demais para entrar na célula. Este é um problema que confunde muitos desenvolvedores de drogas:métodos de entrega.
A Dra. Ohkanda pensou se ela poderia projetar racionalmente o tiol na extremidade do K-Ras para enganchar no bolso ativo do FTase e GGTase I, a porção de carga positiva interativa estendida poderia interagir e penetrar na membrana celular. Se a porção de cisteína pudesse se prender na cavidade, a cadeia positiva interativa conectada pode ser pequena e distribuída estrategicamente na superfície ácida das enzimas. Era difícil minimizar o tamanho do composto enquanto aumentava sua estabilidade e mantinha sua capacidade de reações químicas. Usando um peptídeomimético de mesmo comprimento e mesma chave, eles foram capazes de penetrar com sucesso na célula in vitro, interrompendo a multiplicação K-Ras descontrolada.
Mais estudos são necessários para aumentar a atividade do composto, teste in vivo e para avaliar sua toxicidade muito antes de o composto poder ser usado como um tratamento para câncer. Dr. Ohkanda continua a trabalhar com uma equipe internacional de especialistas para elucidar o mecanismo de ação e suas interações para projetar racionalmente medicamentos eficazes para interromper a multiplicação de tais células.