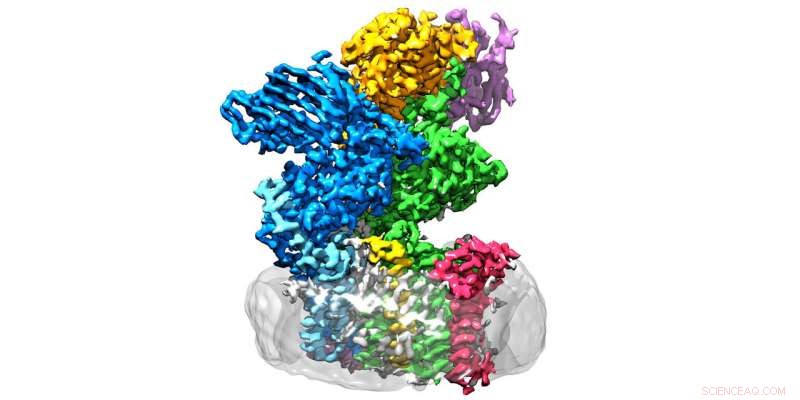
A enzima oligossacariltransferase está localizada na membrana (cinza) e consiste em oito subunidades. Crédito:Julia Kowal / ETH Zurique
Os pesquisadores da ETH conseguiram determinar a estrutura 3-D da enzima que liga as cadeias de açúcar às proteínas - um avanço que eles publicaram recentemente no jornal Ciência .
Sempre que as células recebem sinais, interagir com outras células ou identificar vírus e bactérias, o processo envolve não apenas proteínas, mas também cadeias de açúcar ligadas à sua superfície. O assunto de relativamente pouca atenção até agora, essas estruturas diferem amplamente em composição e ramificação, e parecem ajudar a garantir que as proteínas se dobrem corretamente e sejam capazes de realizar suas tarefas específicas.
Várias observações demonstram a importância dos apêndices açucarados:proteínas idênticas com diferentes cadeias de açúcar têm funções diferentes, células doentes e saudáveis têm diferentes composições de açúcar em suas superfícies, e os medicamentos aos quais estão associados são aparentemente mais tolerados.
Como o açúcar chega à proteína?
Conhecidos como glicanos, essas substâncias são atualmente objeto de intensa pesquisa. Depois da genômica e proteômica, agora também há glicômicos. O campo de pesquisa emergente da glicobiologia lida com biossíntese, estrutura e as diversas funções dos apêndices açucarados. Uma questão chave é como o conjunto diversificado de moléculas de açúcar chega às proteínas em primeiro lugar.

Imagens do microscópio crioeletrônico da enzima. Crédito:Rebekka Wild / ETH Zurich
Os pesquisadores da ETH nos grupos liderados por Kaspar Locher do Instituto de Biologia Molecular e Biofísica e Markus Aebi do Instituto de Microbiologia deram agora um passo decisivo em frente nesta área:eles determinaram a estrutura tridimensional da oligossacariltransferase (OST) em fermento. "Esta é a enzima que conecta as proteínas às árvores de açúcar, "explica Rebekka Wild, um dos três autores principais do relatório em Ciência em que os pesquisadores ETH apresentam suas descobertas.
Determinar a estrutura do OST não foi fácil:para começar, Jilliane Eyring, o terceiro autor principal do relatório, modificou as células de levedura para que a enzima pudesse ser direcionada e purificada. Wild primeiro teve que extrair a enzima, que está embutido em uma membrana na célula, a partir de grandes quantidades dessas células de levedura e, em seguida, purificá-las em um procedimento laborioso. "Nove litros de levedura produziram cerca de 0,2 miligramas de enzima, "diz ela. As moléculas OST foram aplicadas a uma pequena grade, congelado como um indivíduo, partículas separadas e imagens usando um microscópio crioeletrônico de alta resolução.
Isso deu origem a milhares de imagens que mostram o complexo enzimático de todos os ângulos de visão possíveis. A partir dessas imagens, Julia Kowal, o segundo autor principal, gerou a estrutura tridimensional do OST. Demorou seis semanas para realizar os cálculos no cluster de computador. O resultado foi um mapa de densidade de elétrons que mostra a enzima como uma "nuvem de elétrons".
"Aproveitamos um momento de sorte, "Wild explica. Eles puderam se beneficiar da" revolução da resolução "que está ocorrendo atualmente na microscopia crioeletrônica e fizeram uso de um dispositivo de última geração com resolução atômica. O desenvolvimento dessa tecnologia recebeu o Prêmio Nobel em Química em 2017.
A fim de interpretar os dados de microscopia eletrônica, Wild teve que ajustar a sequência de aminoácidos da OST "manualmente" nas pequenas nuvens do mapa tridimensional. Assim, o pesquisador foi capaz de descrever a estrutura 3-D do OST em todos os detalhes - um avanço que foi recebido com prazer entre os pesquisadores depois que foi publicado online.
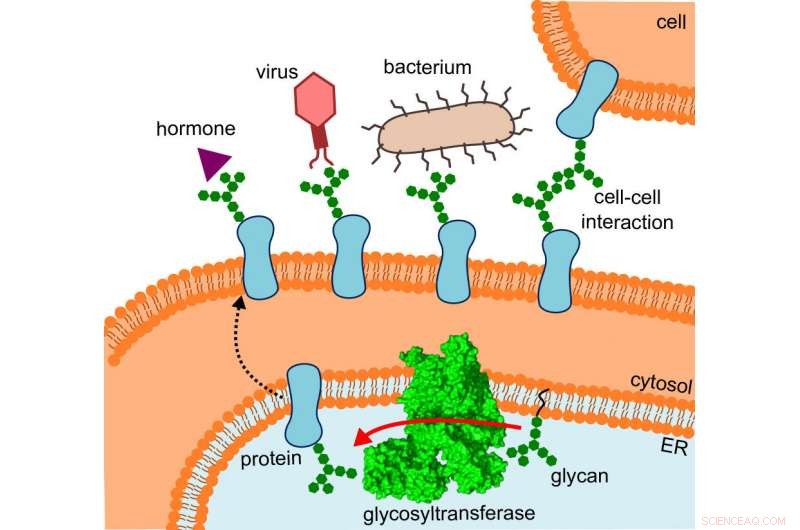
O diagrama mostra onde a glicosiltransferase está localizada, o caminho que as proteínas alteradas tomam e as interações que elas sofrem. Crédito:R. Wild / ETH Zurich
OST é um complexo de proteína de membrana composto por oito subunidades, que identificam, por exemplo, os substratos de açúcar ou proteína ou estabilizam a unidade catalítica. Este último é a subunidade da enzima que abriga o centro ativo, onde proteínas e açúcares são reunidos e fundidos. “Esperávamos que a unidade catalítica estivesse no meio da enzima, "Wild explica." Surpreendentemente, Contudo, está do lado de fora - e o formato lembra uma boca bem aberta. "
O que inicialmente confundiu os pesquisadores de repente fez sentido, como eles ajustaram a estrutura no local onde o OST realmente opera:especificamente, a enzima é incorporada in vivo na membrana do retículo endoplasmático (RE). Esta é a parte da célula onde as proteínas são produzidas, guardada, monitorado e modificado.
Aqui, o vizinho direto do OST é uma proteína de túnel - isso já era conhecido. Isso canaliza as proteínas incipientes para o interior do retículo endoplasmático e, em seguida, diretamente para a boca aberta do OST, onde recebem suas minúsculas árvores de açúcar.
"OST de levedura é um bom modelo para os processos em humanos, "Wild explica. Os pesquisadores tiram essa conclusão do fato de que o centro ativo da OST da levedura, onde as proteínas são equipadas com açúcares, assemelha-se muito à área correspondente nas bactérias. "Isso significa que o centro ativo quase não mudou ao longo da evolução, "explica o pesquisador, "o que significa que há uma boa chance de que ainda funcione de maneira muito semelhante nos mamíferos, e, portanto, também em humanos. "