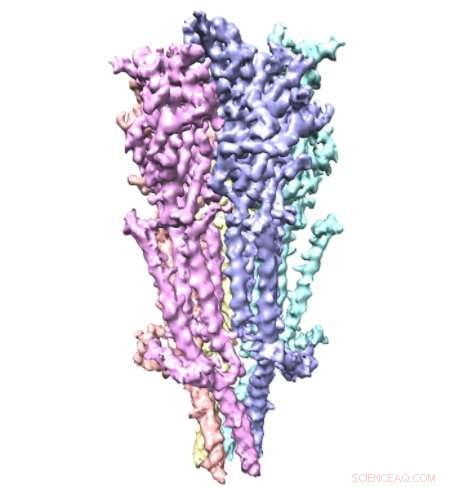
Crédito:Case Western Reserve University
Uma equipe de pesquisadores da Escola de Medicina da Universidade Case Western Reserve usou a tecnologia de microscópio ganhadora do prêmio Nobel para ver os receptores de serotonina de comprimento total pela primeira vez. As minúsculas proteínas - com aproximadamente um bilionésimo de metro de comprimento - são alvos comuns de drogas, apesar das limitadas informações disponíveis sobre sua estrutura. Agora, novas imagens publicadas em Nature Communications fornecem instantâneos dos receptores, incluindo detalhes sobre os locais de ligação molecular que podem levar a um design de drogas mais preciso.
Os receptores de serotonina ficam nas membranas celulares de todo o corpo, incluindo o cérebro, estômago, e nervos. Eles são altamente dinâmicos com muitas peças móveis, tornando-os assuntos difíceis de capturar. Os pesquisadores geralmente quebram o receptor em pedaços para estudá-lo. Mas, ao estudar os receptores de serotonina completos, os pesquisadores do novo estudo mostraram como suas diferentes porções interagem. Os pesquisadores descrevem "uma orquestração bem ajustada de movimentos de três domínios" que permite aos receptores controlar com elegância as passagens através das membranas celulares.
O estudo revela como funcionam os receptores de serotonina, diz o primeiro autor do estudo, Sandip Basak, PhD, pós-doutorado no departamento de fisiologia e biofísica da Case Western Reserve University School of Medicine. "O receptor da serotonina atua como uma porta de entrada, ou canal, de fora da célula para dentro, "diz ele." Quando a serotonina se liga ao receptor, o canal muda a conformação de fechado para aberto. Eventualmente, ele se transforma em um estado "dessensibilizado", onde o canal se fecha, mas a serotonina permanece ligada. Isso impede que seja reativado. "Conformações diferentes ajudam os receptores de serotonina a servirem como" guardiões "nas membranas celulares.
Drogas que se ligam aos receptores de serotonina e os inibem - também chamadas de Setrons - são amplamente prescritas para controlar o vômito associado a terapias de câncer e doenças gastrointestinais. Mas muitos desses medicamentos apresentam efeitos colaterais graves. "Muitas pessoas que tomam esses medicamentos apresentam sintomas desagradáveis. Esses efeitos colaterais impediram o uso mais generalizado, "diz o líder do estudo Sudha Chakrapani, PhD, professor associado de fisiologia e biofísica na Case Western Reserve University School of Medicine. Ela sugere que o desenvolvimento de drogas que tenham como alvo a conformação específica dos receptores de serotonina pode ajudar.
"O projeto bem-sucedido de terapêuticas mais seguras diminuiu porque atualmente há uma compreensão limitada da estrutura do próprio receptor de serotonina, e o que acontece depois que a serotonina se liga, "Chakrapani diz." Nossa nova estrutura do receptor de serotonina no estado de repouso tem o potencial de servir como um projeto estrutural para direcionar o design de drogas direcionadas e melhores estratégias terapêuticas.
A estrutura recém-revelada prepara o terreno para determinar as estruturas do receptor nas formas ativa e ligada ao medicamento. Essas descobertas são cruciais para pintar um quadro completo de como o receptor funciona. Os pesquisadores poderiam aplicar a mesma tecnologia usada no novo estudo - microscopia crioeletrônica - para revelar conformações adicionais do receptor de serotonina. A tecnologia ganhou o prêmio Nobel de 2017 e já ajudou os pesquisadores a resolver estruturas 3D para proteínas centrais de pedras nos rins e outras doenças. "Cryo-EM" permite que os pesquisadores ampliem e vejam as estruturas das proteínas em detalhes atômicos. Os microscópios de alta potência tiram instantâneos de proteínas em ação, e compilá-los em modelos estruturais 3D.