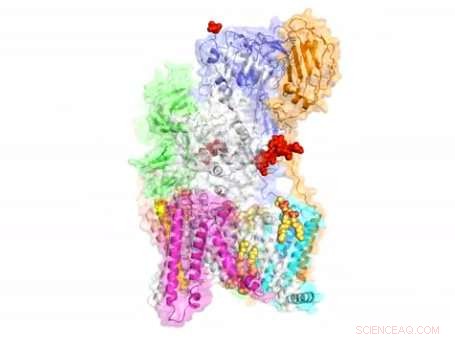
Os cientistas revelaram a estrutura de nível atômico de um complexo molecular responsável pela modificação de proteínas, possivelmente abrindo caminho para o desenvolvimento de novos medicamentos para o câncer e uma série de outras doenças.
O complexo, conhecido como OST, é um jogador chave na glicosilação de proteínas, um processo celular amplamente disseminado que está intimamente ligado a inúmeras funções no corpo humano. Ele age adicionando açúcares chamados glicanos às proteínas, influenciando sua forma e, como resultado, sua função.
"A determinação da estrutura de nível atômico da OST é um avanço na glicobiologia, "disse Huilin Li, Ph.D., professor do Van Andel Research Institute (VARI) e autor sênior de um estudo que descreve a estrutura do OST publicado hoje em Natureza . "Como uma enzima chave na via de biossíntese do glicano ligado ao N, OST é importante tanto na saúde quanto na doença. Esperamos que essas descobertas levem a terapias de mudança de vida para o câncer e muitos outros distúrbios. "
A maioria das proteínas modificadas por OST são secretadas ou ficam embutidas na membrana da superfície celular, onde atuam como um canal entre a célula e seu ambiente. Sua exposição aos arredores das células e a presença de glicanos os tornam alvos ideais para novos medicamentos, que costumam usar assinaturas químicas específicas de glicanos para atingir uma célula cancerosa, por exemplo.
Embora o OST tenha sido descoberto há muitas décadas, sua estrutura permaneceu obscura. A estrutura atômica da OST descrita no artigo de hoje é de fermento de padeiro, um modelo simples e elegante para pesquisa biomédica.
Ao contrário de outros complexos que são montados por interações entre proteínas, as oito proteínas de membrana que compõem a OST são amplamente "coladas" umas às outras por sete moléculas de fosfolipídios no centro de sua estrutura. Esses lipídios dificultavam a purificação do complexo para análise estrutural.
"A complexidade e a novidade da estrutura do OST são verdadeiramente notáveis, "disse Lin Bai, Ph.D., um cientista pesquisador sênior no laboratório de Li e o primeiro autor do artigo. “A estrutura é o culminar de mais de uma década de trabalho, e fornece clareza e visão importantes sobre um processo celular comum que afeta metade das proteínas do corpo humano. "
A estrutura sugere papéis funcionais para suas oito proteínas componentes, que foram recrutados para a enzima do núcleo catalítico ao longo de bilhões de anos de evolução. Algumas dessas proteínas foram encontradas para reconhecer o glicano substrato doador ou proteínas aceitadoras, enquanto outros se coordenam com a síntese de proteínas e maquinário de translocação de proteínas - processos que são vitais para manter a vida.
A estrutura também revela os principais locais de reação que podem ser visados por medicamentos projetados para corrigir disfunções em doenças como o câncer.
OST é a terceira estrutura molecular a ser visualizada pela suíte de microscopia crioeletrônica avançada David Van Andel do Instituto, que permite aos cientistas ver alguns dos menores componentes da vida em detalhes requintados. O maior microscópio da VARI, o titã Krios, é um dos menos de 120 no mundo e é tão poderoso que pode visualizar moléculas em nível atômico, até 1/10, 000º da largura de um cabelo humano.