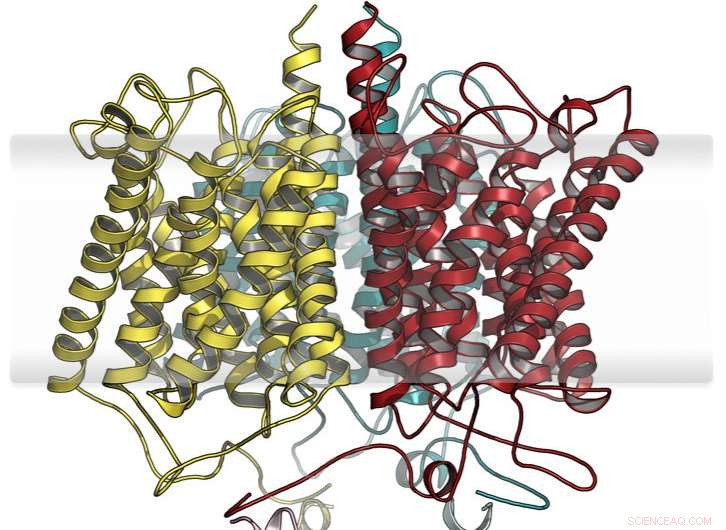
Modelo hipotético estendido da proteína do sensor de amônio anammox. Crédito:Susana Andrade
Uma equipe liderada pela bioquímica de Freiburg, Profa. Dra. Susana Andrade, caracterizou uma proteína que permite a certos microrganismos reconhecer e absorver amônio em seu ambiente. O amônio é considerado uma toxina que polui os ecossistemas, mas para essas bactérias representa um nutriente e uma fonte de energia importante. Os pesquisadores publicaram suas descobertas na revista científica Nature Communications .
O elemento nitrogênio é um bloco de construção indispensável de todas as biomoléculas e, portanto, de grande importância para todos os organismos. Além disso, alguns membros da comunidade microbiana se especializaram no uso de vários compostos de nitrogênio como fonte de energia para um crescimento ideal. Este é especialmente o caso entre oxidantes anaeróbicos de amônio:essas bactérias não requerem oxigênio para seu metabolismo, mas em vez disso, converter dois compostos de nitrogênio importantes, amônio e nitrito, em gás nitrogênio, que representa cerca de 80 por cento da atmosfera terrestre. Por meio dessa reação, esses microrganismos desempenham um papel importante na desintoxicação de compostos de nitrogênio que são cada vez mais liberados no meio ambiente por meio do uso de fertilizantes.
Andrade e sua equipe da Faculdade de Química e Farmácia da Universidade de Freiburg identificaram uma proteína incomum nessas bactérias:metade dela se assemelha a proteínas de transporte conhecidas de íons amônio e a outra metade pertence a um grupo de proteínas transdutoras de sinal. Isso levou à suspeita de que dois blocos de construção, já existente na natureza, foram combinados de forma modular para permitir uma funcionalidade completamente nova:a detecção de amônio do ambiente e posterior transmissão desta informação para as redes de sinalização celular.
Os pesquisadores realizaram uma caracterização funcional e estrutural abrangente desta nova proteína, que também envolveu grupos de trabalho do University Medical Center Freiburg; Radboud University em Nijmegen, Os Países Baixos; a Academia Russa de Ciências; e o Laboratório Europeu de Biologia Molecular (EMBL) em Hamburgo. Como resultado, a suposição original foi confirmada:com base em uma proteína de transporte de amônio altamente seletiva, a evolução deu origem a um novo local de reconhecimento para os íons, cuja ocupação leva a mudanças conformacionais que são repassadas ao módulo transdutor de sinal. Este acoplamento modular direto oferece a perspectiva de fundir outras unidades de transdução de sinal ao módulo sensor de amônio para projetar novas funcionalidades celulares.