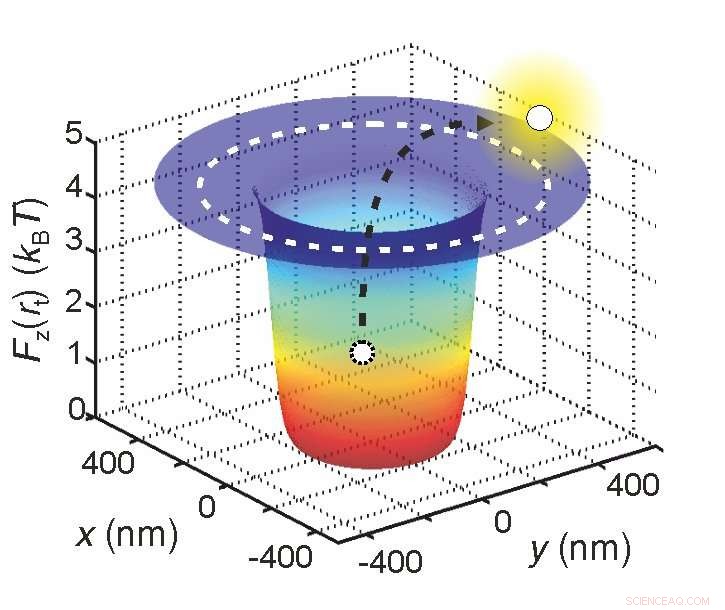
Os cientistas podem determinar a carga elétrica efetiva de uma molécula prendendo-a em um poço de potencial medindo quanto tempo ela permanece dentro dela. Crédito:Madhavi Krishnan / Universidade de Zurique
Pela primeira vez, os cientistas mediram com precisão a carga elétrica efetiva de uma única molécula em solução. Esta visão fundamental de um professor SNSF também pode abrir caminho para diagnósticos médicos futuros.
A carga elétrica é uma das principais propriedades que permitem que as moléculas interajam. A própria vida depende deste fenômeno:muitos processos biológicos envolvem interações entre moléculas como proteínas, onde sua carga desempenha um papel essencial. Ainda, a carga de uma proteína em um ambiente aquoso - seu contexto natural em um organismo vivo - é difícil de determinar com precisão usando abordagens tradicionais.
Madhavi Krishnan, que tem um cargo de professor SNSF na Universidade de Zurique, desenvolveu um método para medir com precisão a carga de uma única molécula em solução. Seu avanço foi descrito em uma série de artigos em Nature Nanotechnology , Revisão Física E e a Journal of Chemical Physics . Esta descoberta pode abrir caminho para novas ferramentas de diagnóstico, uma vez que, em um nível químico, muitas doenças estão ligadas a uma mudança na carga elétrica de uma proteína, o que impede a molécula de agir da maneira que deveria.
A carga elétrica de uma molécula pode ser bastante diferente na fase gasosa e em solução. A razão para essa diferença reside nas complexas interações entre o objeto e o líquido circundante. Portanto, medições padrão de fase gasosa não fornecem informações diretamente sobre o comportamento da molécula em seu contexto biológico.
"Como crianças chutando uma bola"
As moléculas em solução estão em movimento constante, chutando um ao outro aleatoriamente. Krishnan e Ph.D. a aluna Francesca Ruggeri aproveitou este fenômeno conhecido, chamado movimento browniano, para medir a carga efetiva de uma molécula diretamente em solução.
Primeiro, eles aprisionaram a molécula em um "poço de potencial". Em vez de um poço real, esta é uma situação em que a energia potencial da molécula está no mínimo. Em tal situação, as moléculas de água em movimento tentam continuamente expelir a molécula do poço.
"É como crianças brincando com uma bola no fundo de uma cova, "explica Krishnan." A bola é a molécula em que estamos interessados, e os filhos são as moléculas de água. A bola teria que receber um chute bastante forte para voar para fora da cova. "
Quanto maior a carga efetiva da molécula, quanto maior a profundidade do poço potencial e, consequentemente, menor a probabilidade de a molécula ser ejetada do poço. Na prática, isso significa que o tempo necessário para a molécula ser expulsa do poço está diretamente relacionado à sua carga efetiva.
"Em última análise, tudo se resume a um princípio estatístico, "explica Krishnan." Se soubermos quanto tempo uma molécula permanece presa no poço, sabemos precisamente quão profundo é o poço. E uma vez que essa profundidade depende diretamente da carga efetiva da molécula, podemos deduzir esse valor com muita precisão também. "
Duas placas de vidro
Para criar um poço potencial, cientistas comprimiram uma solução contendo as proteínas entre duas placas de vidro, um deles sendo coberto com orifícios microscópicos. Moléculas presas em poços potenciais foram marcadas com agentes fluorescentes, o que permitiu que eles fossem rastreados com um microscópio óptico.
Embora a descoberta tenha implicações fundamentais importantes, também pode abrir caminho para novas ferramentas de diagnóstico para muitas doenças causadas por proteínas deformadas, como Alzheimer e cânceres. "Nós sabemos que a conformação 3-D de uma proteína influencia sua carga efetiva, e nosso trabalho pode apresentar uma nova rota para detectar proteínas defeituosas. "