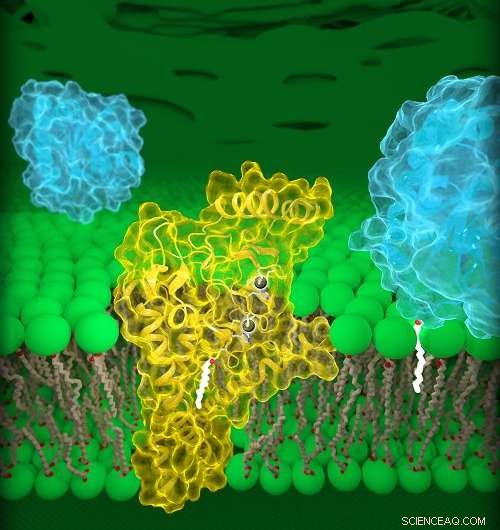
DHHC20 humano (amarelo) está incorporado na membrana de Golgi (verde), um compartimento localizado dentro das células. DHHC20 anexa uma cadeia de ácido graxo (branco) a uma proteína alvo (azul, primeiro plano), que ancora a proteína à membrana de Golgi. Crédito:Jeremy Swan, NICHD / NIH
A primeira estrutura tridimensional das proteínas DHHC - enzimas envolvidas em muitos processos celulares, incluindo câncer - explica como eles funcionam e pode oferecer um modelo para o desenvolvimento de drogas terapêuticas. Os pesquisadores propuseram o bloqueio da atividade do DHHC para aumentar a eficácia dos tratamentos de primeira linha contra as formas comuns de câncer de pulmão e mama. Contudo, atualmente não há medicamentos licenciados que visem enzimas DHHC específicas. O estudo, liderado por pesquisadores do Instituto Nacional de Saúde Infantil e Desenvolvimento Humano (NICHD) Eunice Kennedy Shriver, aparece na última edição de Ciência .
Enzimas DHHC, também chamado de palmitoiltransferases, modificar outras proteínas anexando a elas uma cadeia de lipídios, ou ácidos graxos, de comprimentos variados. Esta modificação, chamada palmitoilação, pode alterar muitas propriedades de uma proteína alvo, como sua estrutura, função e localização dentro de uma célula. Os pesquisadores estimam que quase 1, 000 proteínas humanas sofrem palmitoilação, incluindo receptores do fator de crescimento epidérmico (EGFRs). Um EGFR bem conhecido é HER2, que é superativado em formas agressivas de câncer de mama. EGFRs também podem ser superativados no câncer de cólon, e câncer de pulmão de células não pequenas, o tipo mais comum de câncer de pulmão.
O estudo atual detalha as estruturas de uma enzima DHHC humana, DHHC20, e a versão do peixe-zebra de outra enzima DHHC, DHHC15. Mais importante, DHHC20 é a enzima que palmitoila o EGFR. Estudos anteriores mostraram que o bloqueio do DHHC20 torna as células cancerosas mais vulneráveis aos tratamentos existentes aprovados pela FDA que têm como alvo o EGFR. Portanto, compreender a estrutura do DHHC20 pode ser importante para o tratamento de cânceres dirigidos por EGFR.
"Mutações nas enzimas DHHC estão associadas a vários tipos de câncer e distúrbios neurológicos, "de acordo com Anirban Banerjee, Ph.D., o principal autor do estudo e chefe da Unidade de Biologia Química e Estrutural de Proteínas de Membrana do NICHD. "Nosso estudo oferece um ponto de partida para o desenvolvimento de inibidores de DHHC20 que podem auxiliar no tratamento de cânceres comuns e avançar no campo da palmitoilação de proteínas."
Dr. Banerjee e colegas identificaram um componente estrutural, uma cavidade, de DHHC20 que influencia o comprimento de sua cadeia lipídica. Mutações que alteraram o tamanho relativo desta cavidade fizeram com que o DHHC20 usasse cadeias lipídicas mais curtas ou mais longas, que presumivelmente altera os efeitos da palmitoilação em uma proteína-alvo. Os pesquisadores propõem que a estrutura desse site explica por que diferentes enzimas DHHC usam certas cadeias lipídicas para modificar as funções de outras proteínas. Ele também oferece uma visão sobre como várias enzimas atuam juntas em estados de saúde e doença.